推荐产品
公司新闻/正文
干货 | 心血管系统工具病毒注射方法与应用
人阅读 发布时间:2019-08-15 13:53
干货 | 心血管系统工具病毒注射方法与应用
工具病毒在心血管系统的注射方法总体上包括静脉注射、心腔内注射、心肌内定点注射、心包内注射(介于心肌与心包膜之间),其中静脉注射包括尾静脉注射、颈静脉注射、面部静脉注射等。下图是一些常见的心血管系统病毒注射方法以及EGFP通过不同实验手法在心肌细胞中的表达情况。
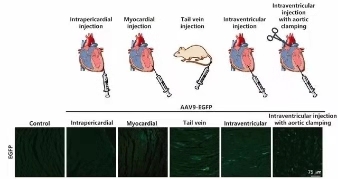
其中最常用的是心肌定点注射和尾静脉注射病毒的方法,下面详细介绍两种方法的比较、实验流程及相关注意事项。
a. 心肌内定点注射时每点注射2-5 ul,效果是在注射的局部点附近可以达到很好的表达效果,但扩散范围有限,并且心脏定点注射需要开胸并辅助呼吸,对手术操作要求较高,也需要花费更长的操作时间。
b. 由于尾静脉注射的方法较为简单,很多老师直接用尾静脉注射方法,但由于心脏血流太快,或者由于病毒进入血液系统以后,肝脏的首过效应,使尾静脉注射的病毒不容易富集在心脏(反而在肝脏的富集程度更高),因此相比其他器官,尾静脉注射需要更高的病毒量。
c. 有文献比较了腺病毒载体通过小鼠尾静脉注射或心肌注射后心肌组织的转染效率。结果表明,心肌注射组GFP的表达水平明显高于尾静脉注射组[1]。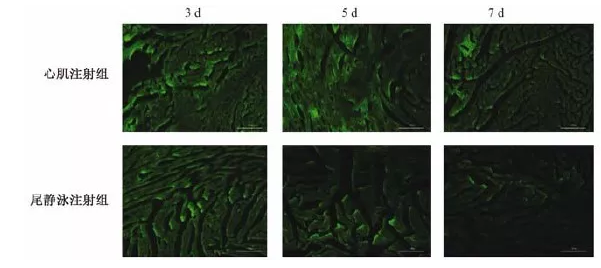
2.心脏原位注射(以大鼠为例)
2.1 实验前的准备及注意事项
仪器器械准备: a. 开胸制作大鼠心梗模型,维持动物呼吸至关重要,在手法不够熟悉的时候需要使用呼吸机来维持动物呼吸;b. 由于大鼠胸腔、心脏体积均较小,需要使用精细的眼科器械。
动物准备: a. 首先应选择成年健康大鼠,耐受性较好;b. 务必先熟悉心脏、胸腔部位的解剖结构,这样一方面通过了解血管分布,避免误伤血管导致动物死亡,另一方面了解心脏组织的组成(例如心肌的厚度分布等),这样在后面注射病毒时才能做到心中有数,这一点非常重要;c. 需要进行多次预实验以了解实验流程,如果大鼠死亡,不要着急扔掉,可以用它练习大鼠的解剖结构和不熟悉的操作步骤,直到熟练为止。d. 一般熟练地进行心肌注射也需要30到40分钟的时间,在摸索实验时,注意锻炼自己平和的心态。
2.2 实验流程
下面以气管切开插管,心肌定点注射病毒为例。
a. 固定大鼠仰卧于手术台上。剪除颈部及胸部被毛。
b. 纵形剪开颈部皮肤1.5~2cm,分离皮下组织及肌肉,并显露其上甲状腺腺体。
c. 于腺体后方钝性分离气管并带线,注意勿损伤腺体及血管,提起丝线,剪刀于气管环之间剪开气管半周。
d. 行气管插管,接呼吸机。调整呼吸频率、吸呼比及潮气量(常见潮气量为2~3 ml /次,呼吸频率为60次/min,呼吸比为1∶1.5,需要根据呼吸机使用指南及大鼠表现调节)。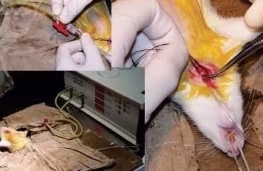
e. 胸骨左缘3 mm纵形剪开胸部皮肤约4 cm。钝性分离皮下、胸大肌与前锯肌。第三肋间逐步剪开肋间肌,显露胸膜。
f. 找准进入位点,一般是在在心跳明显处,用镊子于呼气时刺破胸膜,进入胸腔。撑开肋骨,撕破心包,显露心脏。必要时可于左外侧垫纱布隔开左肺。
g. 在心肌表面,注射病毒,可以以心脏长轴距离心尖0.5 mm处为中心,在其上下左右2 mm处分四点于心肌内注射病毒,注射成功后可见局部颜色由红色转为白色,也可以根据想要标记的肌肉大小进行调整,一般都选择多点注射病毒,病毒扩散效果比较好。病毒注射以后,探查无出血后关胸,注意勿缝到心肺及血管。在缝合过程中胸腔留置吸引管一根,其他部分的肌肉皮肤进行逐层缝合。

h. 在缝合完毕以后,针筒抽吸胸腔积气积液,并拔除吸引管。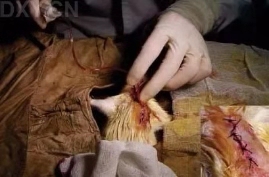
i. 大鼠苏醒后,待其状态良好,拔除气管插管,停止人工呼吸,清除气道血块及分泌物,进行一针缝合气管及肌肉切口,并将小鼠放回鼠笼常规喂养。
2.3 几点注意事项
a. 如果之间经口插管建立辅助呼吸,那么气管插管次数不宜太多,因插管次数太多易致喉水肿而窒息死亡,插管时用小镊子拉出鼠舌,顺舌根插成功率较高,插管后接呼吸机,若小鼠胸廓起伏与呼吸机频率一致,提示插管成功。
b. 心肌定点注射病毒时,注意排空注射器内空气,以免造成空气栓塞导致小鼠死亡。
c. 由于小鼠心肌比较薄,故注射液体时注射器针头不能刺入太深以防注入心腔。
3.1 注意事项:
a. 尾静脉扩张: 应该保持实验室温度在26度左右,尤其是冬季,适宜的室内温度对小鼠尾静脉有一定的扩张作用并且能够使血流通畅以降低注射阻力。目前使用较多的是用酒精涂擦使尾静脉扩张,也有使用红外线灯加热小鼠尾部,另外有报道使用硝酸甘油扩张尾静脉从而降低穿剌难度,且其效果优于 75%乙醇。有文献建议使用热水浸泡联合酒精涂擦法能使尾静脉扩张更充分,其效果优于单用热水浸泡法和单用酒精涂擦法[2]。但是水浴的温度以50度-60度较为适宜,温度太低则尾静脉扩张效果不理想,若温度超过70度则容易烫伤皮层,甚至在拉尾固定的过程中小鼠挣扎导致皮层脱落并出血,容易诱发感染。
b. 注射剂量: 单次小鼠尾静脉注射剂量不宜过大,大剂量迅速推注容易造成小鼠循环超负荷导致猝死,特别是悬浮颗粒型液体更容易造成栓塞,导致小鼠死亡,因此推注药物的过程应该缓慢并观察小鼠的反应。我们建议的注射剂量为200 ul每只,即约为全血体积的14%。
c. 手感确定再推针:在最开始练习时,往往一针没扎进血管,或者扎进血管又穿出血管,发现推针时阻力很大,此时强行推注会把液体打到血管外的组织里,把尾巴上打“白”一小段。这时候,白色以下的尾巴在恢复前就暂时不能用了。扎偏了其实并不可怕,抽出来一点,换个角度再扎,直到你感觉稳了,手感上确实感觉打准了,再推针,这样可以减少尾巴的损伤。
d. 鼠尾远端开始注射:除了工具病毒的注射往往只需要尾静脉注射一次,但是在做长期连续给药的实验时,我们需要从尾巴的最远端开始注射,这样可以最大程度地节省尾巴的损伤。
3.2 实验流程
a. 首先需要有一个固定小鼠的装置,目的仅使小鼠的尾巴固定,但小鼠有活动余地,无需麻醉。可以买专用的小鼠固定器,也可以用离心管甚至烧杯代替。
b. 我们知道小鼠尾部有4根明显的血管:背腹各有一根动脉,两侧各有一根静脉,而两侧尾静脉比较容易固定,成功率也最高。准备一个酒精棉,开始对着小鼠的尾巴擦酒精,用撸的手法,撸到血管充盈。在选择一根血管以后,此时左手食指中指夹住老鼠尾巴,这样不论小鼠在前面如何晃动尾巴都基本不动,以无名指为支点,与大拇指配合将尾巴弯曲,曝露出进针的位点,尾巴弯曲的地方就是我们进针的位置,进针手法正面和侧面观察如下图所示。
c. 注意针尖与血管平行的角度进针。然后就可以注射病毒了,注射完病毒后,用无酒精棉花止血(千万不能用酒精棉,酒精会加速出血)。
以上就介绍了两种心血管系统工具病毒注射的常用方法,方法归方法,实际操作还是要进行不断的操练,熟练方能生巧!
吉凯基因现推出神经系统专用AAV彩虹试用装,仅需1400元,5个工作日,您就可以试用包括1、Retro、9等神经示踪AAV病毒,为您的神经科学研究助力。
另外,吉凯基因为您提供口碑好、高质量的AAV工具产品,血清型包括1、2、5、7、8、9、DJ、DJ/8、PHP.eB-301、PHP.B-301、PHP.S-301、Retro等常规、跨血脑屏障以及逆行标记类型,研究领域涉及心、肝、肺、胰、肌肉、神经、眼科学等各个领域。同时,我们于2015年在国内率先建立了cGMP级病毒生产车间,可提供临床级别的基因治疗载体病毒,旨在为基因治疗贡献一份力量!详情戳:http://www.taogene.com/?pf=pc#/category
参考文献:
[1] 杨琳珊, 占贞贞, 汪波. 小鼠尾静脉注射与心肌注射腺病毒载体转染效率的比较, 中国比较医学杂志, 2016, 26(8): 42-46.
[2] 陈育尧, 黄雪玲. 小鼠尾静脉注射法, 毒理学杂志, 2008, 22(4): 311-312.