推荐产品
公司新闻/正文
Cell Death Differ:山大张利宁教授团队首次揭示TFEB在蛋白质翻译水平上的调控机制
人阅读 发布时间:2020-12-28 10:16
溶酶体是细胞内重要的终末降解细胞器,是细胞的循环中心和维持细胞代谢稳定的关键。近年研究发现,溶酶体还能参与许多其他的细胞过程,包括抗原递呈、质膜修复、肿瘤转移侵袭和代谢信号传导等过程。此外,溶酶体功能障碍已被证实不仅是罕见的溶酶体储存障碍相关疾病的基础,也是许多常见疾病的发生基础,如癌症和神经退行性疾病。
TFEB是调控溶酶体的关键转录因子,能够调控大约90%的溶酶体和自噬相关的基因表达,包括溶酶体水解酶、溶酶体膜蛋白和自噬蛋白等基因。研究证实,TFEB的表达或激活能够增加细胞的溶酶体发生和溶酶体功能,显著改善溶酶体储存障碍相关疾病和神经退行性疾病模型的疾病表型。然而,TFEB本身的转录和翻译调控机制尚不清楚。
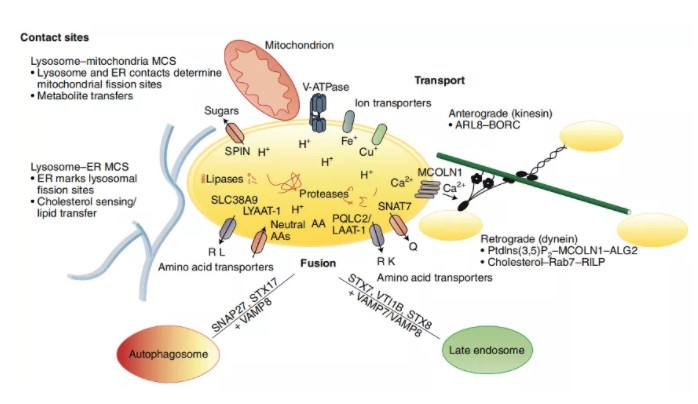
The lysosome as a cellular centre for signalling, metabolism and quality control Nat Cell Biol. 2019 Feb;21(2):133-142.
2020年10月25日,山东大学基础医学院张利宁教授团队在国际权威期刊Cell Death & Differentiation(中科院JCR期刊1区,2019年影响因子IF :10.717,5年影响因子9.597)上在线发表了题为“Programmed cell death 4 modulates lysosomal function by inhibiting TFEB translation”的研究成果。文章首次阐明了TFEB在蛋白质翻译水平上的调控机制,为明确TFEB的调控网络提供了重要理论基础。
研究方法
该研究中,张利宁教授团队结合前期已经发表的PDCD4抑制自噬相关基因ATG5表达和PDCD4敲除促进巨噬细胞中脂质降解并抑制动脉粥样硬化发生的相关结果,在多种细胞和动物水平证明了PDCD4通过其MA3结构域以eIF4A依赖的方式抑制TFEB的蛋白质翻译,进而在全局水平上调控TFEB,抑制其细胞核定位和转录活性,抑制溶酶体发生和溶酶体功能。PDCD4基因敲除巨噬细胞通过上调TFEB表达,抑制肿瘤相关巨噬细胞向M2型极化,提高巨噬细胞抗肿瘤能力。研究结果首次阐明了TFEB的蛋白质翻译调控机制,完善了TFEB的调控网络;首次发现PDCD4基因敲除显著提高肿瘤相关巨噬细胞的抗肿瘤能力,为治疗溶酶体相关疾病、神经退行性疾病和肿瘤提供药物靶点和理论指导。
细胞的溶酶体活性和功能主要表现在溶酶体的形态、大小、数目以及溶酶体酶的活性等方面,为探究PDCD4是否参与并调控溶酶体功能,作者使用WT和KO小鼠的原代骨髓来源巨噬细胞和小鼠原代胚胎成纤维细胞,通过基因干扰和过表达技术,使用免疫荧光(图1a-c)、流式细胞术(图1d-f)、免疫蛋白印记(图1g-i)和实时定量PCR(图1j-l)技术分别检测了溶酶体形态、活性和数量。结果显示PDCD4通过TFEB负向调控溶酶体发生和溶酶体功能。

图1. PDCD4通过TFEB负向调控溶酶体发生和溶酶体功能
那么PDCD4是如何调控TFEB表达抑制溶酶体发生和功能的呢?
作者使用了实时定量PCR和免疫蛋白印迹,分别在BMDM细胞、Hela细胞和THP-1细胞中敲除或敲低PDCD4(图2.a-b, e-g),在MEF和HEK-293T细胞中梯度过表达PDCD4(图2.c-d, h-i),检测TFEB在mRNA水平和蛋白水平的表达情况。结果显示,PDCD4不改变TFEB的mRNA表达情况,但在蛋白水平上显著抑制TFEB表达。而PDCD4对TFEB的蛋白质合成和降解也没有明显改变(图2.j-l),说明PDCD4可能在TFEB的蛋白质翻译水平上抑制其表达。
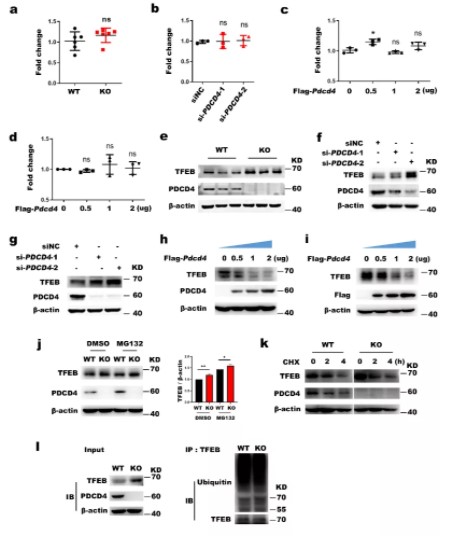
图2.PDCD4抑制TFEB的蛋白质翻译
TFEB的亚细胞决定其功能,具有活性的TFEB定位到细胞核中发挥转录调控作用。结合图2的结果PDCD4抑制TFEB蛋白质翻译和TFEB的整体表达水平。作者猜想,PDCD4是否通过抑制TFEB的总体表达水平来抑制其细胞核定位和转录活性。使用免疫蛋白印迹和免疫荧光检测BMDM细胞和MEF细胞中TFEB的细胞核定位情况(图3.a-d),结果显示,PDCD4敲除促进TFEB整体表达水平的同时也显著促进TFEB的细胞核定位。

图3. PDCD4抑制TFEB的细胞核定位
PDCD4抑制蛋白质翻译主要通过两种方式。第一种方式是PDCD4的MA3结构域与eIF4G竞争性的结合eIF4A,抑制eIF4A的解旋酶活性,抑制真核生物翻译起始因子活性,最终抑制蛋白质翻译起始。PDCD4抑制的这一类分子的mRNA往往具有结构性的5’UTR。另一种方式是PDCD4直接与mRNA相互结合,抑制蛋白质翻译的延伸。接下来,作者探究了PDCD4抑制TFEB翻译的具体机制。使用多种细胞通过干扰或过表达eIF4A,免疫蛋白印迹检测TFEB表达情况(图4. a-d)。结果显示,PDCD4抑制TFEB蛋白质翻译是通过eIF4A依赖的方式。
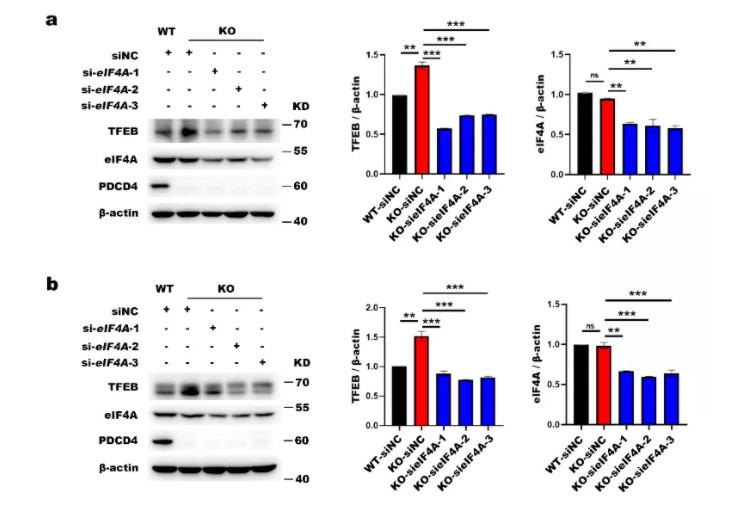
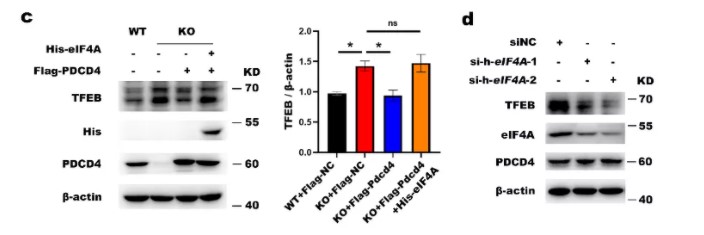
图4. PDCD4以eIF4A依赖的方式抑制TFEB翻译
为了进一步明确PDCD4抑制TFEB翻译的具体机制,使用RNA免疫共沉淀和双荧光素报告酶基因实验,检测PDCD4是否能够结合并调控TFEB mRNA(图5. a-c)。结果显示,PDCD4能够结合TFEB mRNA且对TFEB的三个5’UTR都有调控作用。构建PDCD4的截短体质粒,使用MEF-KO细胞过表达全长和各截短体质粒,检测TFEB的总蛋白表达和入核情况(图5. d-f)。结果显示,截短PDCD4的MA3结构域质粒无法抑制TFEB表达,说明PDCD4通过其MA3结构域抑制TFEB翻译并抑制其入核。

图5. PDCD4通过其MA-3结构域抑制TFEB翻译
PDCD4敲除是否能够提高巨噬细胞的抗肿瘤能力?作者采取了两种体内模型来探究其抗肿瘤能力:第一种方法是在WT和KO小鼠皮下接种肿瘤细胞,监测肿瘤细胞的生长、形态和重量(图6. a-c);第二种方法是使用WT、KO小鼠BMDM细胞和WT、KO干扰TFEB的BMDM细胞与肿瘤细胞混合,接种到野生型小鼠皮下,监测肿瘤的生长、形态和重量(图6. d-g)。最后使用CFSE染色肿瘤细胞,并与巨噬细胞共培养,流式细胞术检测肿瘤细胞的增殖情况和巨噬细胞的极化情况。结果显示,PDCD4敲除的巨噬细胞明显抑制肿瘤细胞增殖(图6. h),抑制巨噬细胞向M2型极化(图6. i)。作者在图8中使用吉凯基因提供的TFEB干扰慢病毒产品(shTFEB-lentiviru和shNC-lentivirus),干扰效果达到70%左右(图6.d)。

图6. PDCD4敲除提高巨噬细胞抗肿瘤能力且依赖于TFEB
总 结
1. 首次阐明了TFEB的蛋白质翻译调控机制,为完善TFEB的调控网络提供理论基础;
2. PDCD4通过其MA3结构域以eIF4A依赖的方式抑制TFEB翻译;
3. 首次发现PDCD4敲除巨噬细胞通过TFEB抑制其M2型极化,提高其抗肿瘤能力。
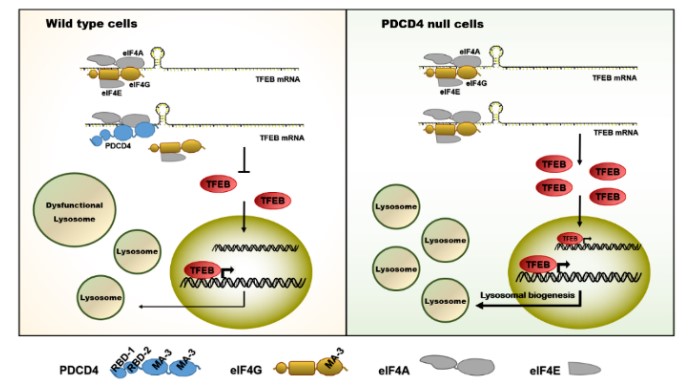
图7. PDCD4调控TFEB翻译和入核模式图
吉凯助力
本研究中所用到的TFEB干扰慢病毒和对照病毒(shTFEB-lentiviru和shNC-lentivirus)由吉凯基因提供,干扰靶点为5′- GGATCAAGGAGCTGGGAAT -3′,干扰效率在70%左右(图6. d, e-i)。

图8. PDCD4敲除提高巨噬细胞抗肿瘤能力且依赖于TFEB

欢迎扫码添加微信,获取免费的工具病毒手册+线上公开课
作者介绍
山东大学基础医学院张利宁教授、李艳、朱法良为本文共同通讯作者,山东大学基础医学院博士研究生陈晓彤为本文第一作者。
张利宁教授
博士,山东大学医学院免疫系主任,二级教授、博士生导师。山东省医学领军人才,曾担任国家自然科技奖函审和会评专家、国家自然基金课题的函审和会评专家及免疫学领域“973”重大课题中期考评专家。主要从事重大疾病的免疫调节研究,最近几年重点关注新的T细胞亚群( Th17、Treg)及新的免疫调控分子(Pdcd4和TIPE2)等在肿瘤和代谢相关炎性疾病(动脉粥样硬化和肥胖)发生发展中的作用,并探索了其干预方法。作为课题负责人承担国家“863”重大专项1项、国家自然基金面上项目8项,作为国内合作者完成国家自然基金-海外杰出青年基金(杰B)基金2项、作为学术骨干承担国家“973”子课题2项。近年来在Molecular Psychiatry,Autophagy、Diabetes和Cellular& Molecular Immunology等有国际影响的学术杂志发表SCI论文69篇,其中通讯作者35篇,获得国家发明专利3项,获山东省科技进步二等奖2项,三等奖3项。