上海吉凯基因医学科技股份有限公司品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
公司新闻/正文
CIRC RES| 南开大学生科院陈佺、廖旭东教授团队,联合天津市第一中心医院心内科卢成志主任在肺动脉高压研究领域取得重要进展
812 人阅读发布时间:2025-02-25 11:27
肺动脉高压(Pulmonary Hypertension,PH)是由多种因素引起的疾病,主要病理特征为进行性的肺动脉血管重构,进而引起肺循环阻力增大,肺动脉压力升高,最终导致右心衰竭和死亡。PH发病机制至今尚未明确,目前研究表明血管内皮细胞功能障碍在PH的肺血管重塑中发挥关键作用。但是内皮细胞线粒体如何调控内皮细胞功能,进而影响肺血管重塑的机制尚不明确。
2024年12月10日,南开大学生命科学学院廖旭东和陈佺老师团队,联合天津市第一中心医院心内科卢成志主任团队在肺动脉高压研究领域取得重要进展,相关研究发表在国际美国心脏协会(AHA)主办的国际权威期刊Circulation Research杂志(中科院一区,2024年影响因子16.5),题为“Endothelial FUNDC1 Deficiency Drives Pulmonary Hypertension”。该研究揭示了FUNDC1调控肺动脉高压发生发展的新机制。

FUNDC1(FUN14 domain containing 1)在低氧诱导的线粒体自噬过程中发挥重要的作用,也参与调节线粒体的动态平衡、数目的变化以及线粒体与其他细胞器的相互作用等。我们发现临床PH病人和PH动物模型的肺组织中FUNDC1表达水平降低。该研究使用小鼠、大鼠肺动脉高压模型和原代培养细胞等多种手段揭示:FUNDC1缺失抑制内皮细胞的线粒体自噬,内皮细胞线粒体ROS大量增多,引发了内皮细胞中线粒体积累,同时促进了内皮细胞向有氧糖酵解的代谢重编程,最终导致了内皮细胞的缺氧和衰老的发生,这可能是通过 mtROS-HIF2α 信号通路实现的。而且FUNDC1缺失的内皮细胞增加了IGFBP2(insulin like growth factor binding protein)的分泌,进而通过旁分泌效应驱动肺动脉平滑肌增殖,促进肺血管重塑。更重要的是内皮诱导性缺失FUNDC1的小鼠会自发发生肺动脉高压。
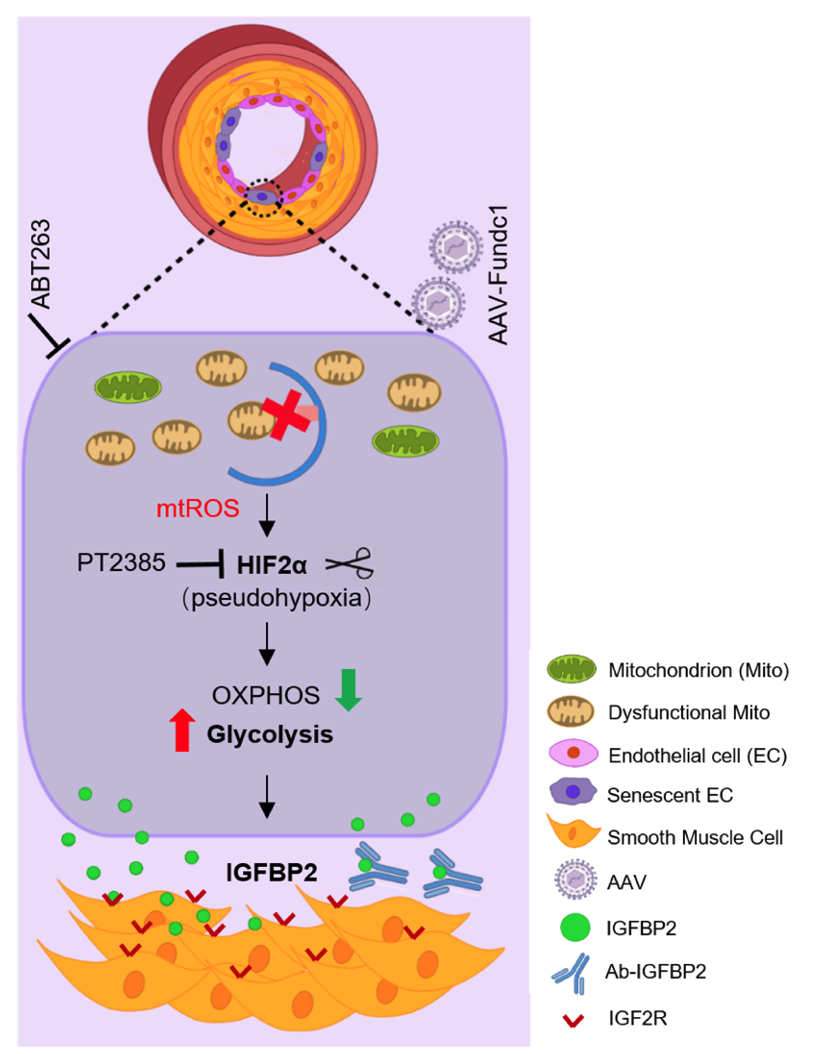
综上所述,FUNDC1介导的线粒体自噬对内皮细胞稳态至关重要,而且内皮线粒体功能障碍是引发PH的独立致病因素。我们通过靶向内皮线粒体功能障碍及其影响的下游靶点,设计了一系列PH预防及治疗实验(PT2385,ABT263和AAV-FUNDC1病毒等),都对改善小鼠PH有显著疗效。该研究中使用的AAV病毒由吉凯基因公司设计并生产。通过气管内滴注感染小鼠,特异性靶向小鼠肺部血管内皮细胞,实现内皮细胞FUNDC1过表达,从而缓解实验动物PH疾病进展。这些靶向实验的结果不仅验证了FUNDC1介导的线粒体自噬参与PH的分子机制,这一研究结果具有重要的临床意义,为 PH 提供了新的治疗策略。
吉凯助力
该研究中使用的AAV病毒由吉凯基因设计并生产。
For viral expression of Fundc1 in pulmonary endothelium, adeno-associated virus 9 (AAV9) carrying a Tie2-promoter-driven FLAG-Fundc1 (AAV-FUNDC1) or EV control was administered intratracheally in a single dose of 1.5×1011 v.g./mouse or 1.0×1012 v.g./rat. Expression of Fundc1 in pulmonary endothelial cells was detected by immunofluorescence. The AAV virus were constructed and purified by Genechem Company (Shanghai, China).
作者介绍
南开大学生命科学学院已毕业博士生裴燕冬、在读博士生任东峰为文章的共同第一作者;南开大学生命科学学院廖旭东教授、陈佺教授以及天津市第一中心医院心内科卢成志主任为论文的共同通讯作者。