上海吉凯基因医学科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
IF15.7 | 复旦大学附属中山医院/MD Anderson癌症中心合作发现肺腺癌铁死亡调控机制!
328 人阅读发布时间:2025-11-10 17:38
近日,复旦大学附属中山医院詹成副研究员团队与美国MD Anderson癌症中心Boyi Gan教授团队在Nature Communications上发表题为“TargetingALDH16A1 mediated thioredoxin lysosomal degradation to enhance ferroptosis susceptibility in SMARCA4-deficient NSCLC”的研究论文。
该研究全面论证了SMARCA4-ALDH16A1-TXN溶酶体降解/功能活性双重调控轴在铁死亡中的核心作用,并为改善SMARCA4缺失型NSCLC化疗或免疫治疗耐药提供了崭新的治疗策略。

本研究所使用敲除/过表达慢病毒均由吉凯基因提供。
研究背景
铁死亡是一种铁依赖性细胞死亡方式,由脂质过氧化物累积引发,其进程受SLC7A11/GPX4等细胞内防御系统精密调控。
近年来,利用铁死亡治疗癌症成为研究热点,研究发现化疗、放疗等多种疗法均可诱发铁死亡,这为克服肿瘤治疗抵抗提供了新思路。特定基因突变可影响肿瘤细胞对铁死亡的敏感性。
本研究在此背景下,深入探索了抑癌基因SMARCA4在铁死亡调控中的作用,其缺失常见于非小细胞肺癌并与不良预后相关。
研究结果
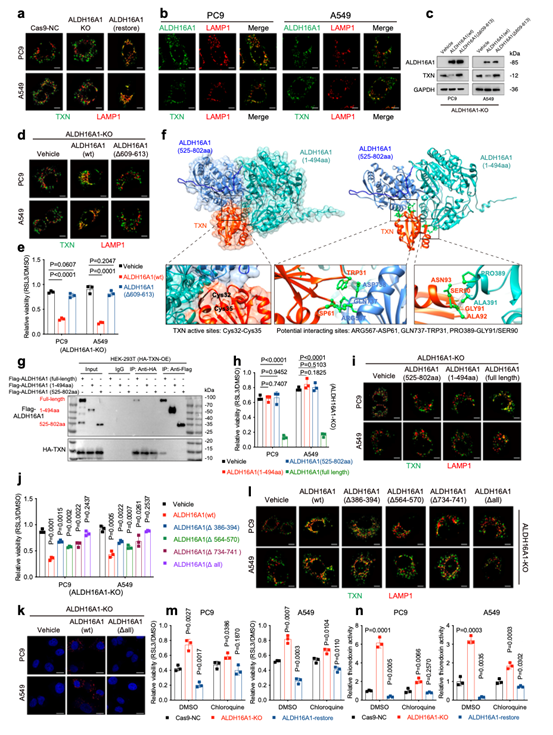
本研究通过全基因组CRISPR/Cas9筛选发现,染色质重塑复合物SWI/SNF的ATP酶亚基SMARCA4是一个重要的铁死亡促进因子。在非小细胞肺癌细胞中,SMARCA4基因敲除显著抑制了由GPX4抑制剂(如RSL3)诱导的铁死亡,表现为细胞存活率提高、脂质过氧化水平降低及线粒体形态异常减少。反之,在SMARCA4缺陷型细胞中恢复其表达,则能重新敏化细胞对铁死亡的响应,且此功能依赖于其ATP酶活性。
该现象在肺癌患者来源类器官模型中得到进一步验证。研究还表明,其同源蛋白SMARCA2在调控铁死亡中作用较弱,凸显了SMARCA4在此过程中的主导地位。这些结果确立了SMARCA4是铁死亡的关键正调控因子。
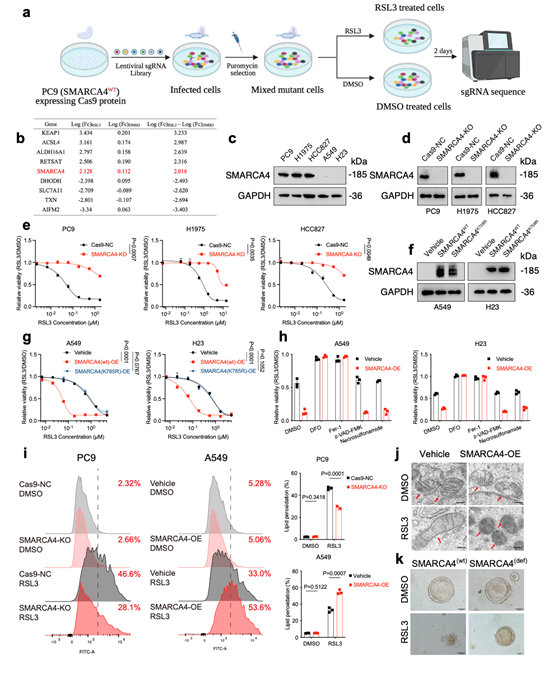
本研究通过多组学整合分析(CUT&TAG、RNA-Seq、ATAC-Seq)深入探究了SMARCA4调控铁死亡的分子机制。
研究发现,SMARCA4并不通过影响经典铁死亡相关因子(如GPX4、SLC7A11等)的表达、谷胱甘肽水平、铁代谢或脂质组成来发挥作用。相反,其作为染色质重塑复合物SWI/SNF的关键亚基,能直接结合并增强ALDH16A1基因增强子区域的染色质可及性,从而正向调控ALDH16A1的转录表达,且此功能依赖于其ATP酶活性。功能实验证实,ALDH16A1是介导SMARCA4促铁死亡效应的关键下游因子。敲除ALDH16A1能显著抑制铁死亡,而其回补则可恢复细胞对铁死亡的敏感性,并能很大程度上逆转SMARCA4缺失或过表达带来的表型。
尤为重要的是,ALDH16A1是ALDH家族中的一个“非典型”成员,它因缺乏关键的催化结构域和辅因子结合位点而并无醛脱氢酶活性。因此,ALDH16A1以一种不依赖于其传统酶活性的全新方式,扮演着促进铁死亡的角色。这一发现突破了ALDH家族成员通常作为铁死亡抑制因子的传统认知,揭示了其调控铁死亡的非经典新功能。
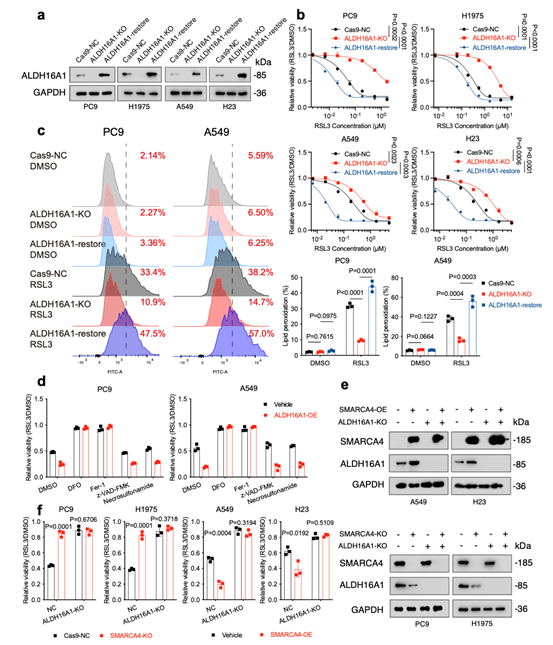
本研究揭示了ALDH16A1通过一种不依赖于其醛脱氢酶活性的全新机制,直接结合并调控抗氧化蛋白硫氧还蛋白(TXN),从而促进铁死亡。具体而言,ALDH16A1作为“适配器”,通过其特有的KFERQ样基序,将TXN转运至溶酶体并促进其降解,此过程依赖于自噬-溶酶体途径。
结构生物学分析表明,TXN分子嵌入ALDH16A1的两个ALDH结构域之间,其N端和C端结构域的三个关键结合位点共同介导了与TXN的相互作用。尤为重要的是,这种结合空间上封锁了TXN活性中心的Cys32-Cys35 motif,直接抑制了其氧化还原酶功能。因此,ALDH16A1通过“双重打击”策略调控TXN:一方面促进其溶酶体降解以减少蛋白丰度,另一方面直接空间阻遏其活性中心以抑制功能。这一定性与功能双重抑制机制,最终削弱了细胞的抗氧化防御能力,从而增强了细胞对铁死亡的敏感性。
吉凯助力
本研究所使用敲除/过表达慢病毒均由吉凯基因提供。
作者简介
复旦大学附属中山医院詹成副研究员、美国MD Anderson癌症中心甘波谊教授、复旦大学附属中山医院蒋伟副主任医师为本文共同通讯作者。复旦大学附属中山医院毕国澍博士、梁嘉琪博士、卞赟艺博士为论文共同第一作者。