上海吉凯基因医学科技股份有限公司品牌商
14 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
Circulation Research:天津医科大学艾玎教授、朱毅教授课题组揭示血流动力学调控血管内皮功能障碍新机制
5540 人阅读发布时间:2020-08-27 11:30
动脉粥样硬化是一类慢性进行性炎症性疾病,其好发于血管的分叉处及弯曲处,这些部位的血流形式主要是不稳定的湍流,其不规则的血流分布导致血管内皮细胞受到不均一的剪切力,内皮功能发生障碍,最终导致动脉粥样硬化的发生。课题组前期的研究发现湍流能够促进内皮细胞integrin α5转位入脂筏,并激活integrin α5及NLRP3炎性小体,介导血管内皮细胞的激活及动脉粥样硬化的形成(PNAS)。然而,湍流是如何调控integrin α5转位进而影响血管内皮功能障碍的具体机制还不是很清楚。
2020年7月16日,天津医科大学艾玎教授、朱毅教授课题组在心血管领域期刊《Circulation Research》(2019年影响因子14.467;5年影响因子15.627)发表了题为“Coupling of integrin α5 to ANXA2 by flow drives endothelial activation”的文章,揭示了湍流介导integrin α5转位激活及动脉粥样硬化发生的新的机制。

研究方法
该研究中,作者通过整合脂筏蛋白质组学以及蛋白结合组学发现ANXA2是湍流介导integrin α5转位入脂筏的关键蛋白,在细胞水平验证湍流通过激活Piezo1-Ca2+-PTP1B引起ANXA2构象的变化,进而引起integrin α5的转位激活;同时,构建ANXA2敲除的小鼠,在动物水平证明ANXA2的缺失能够明显抑制integrin α5的激活及内皮炎症反应。本研究表明Piezo1-Ca2+-PTP1B-ANXA2 信号通路可以作为血流动力学引起的血管内皮功能障碍及动脉粥样硬化新的治疗靶点。
首先,作者通过脂筏蛋白质组学及结合组学联合分析,根据得分(Score)发现ANXA2与integrin α5结合而且都可以脂筏转位(图1A,B),接下来通过免疫荧光染色实验验证湍流可以增加二者的结合(图1C),进一步提取脂筏蛋白发现湍流可以促进ANXA2与integrin α5转位入脂筏(图1D,H),说明ANXA2在integrin α5转位中发挥重要作用。
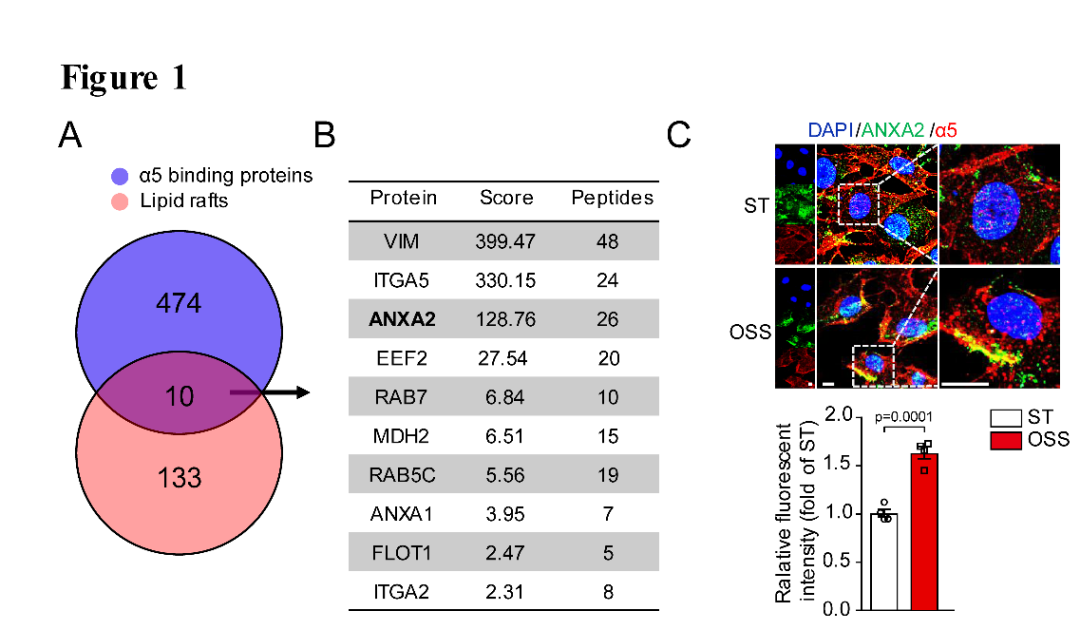
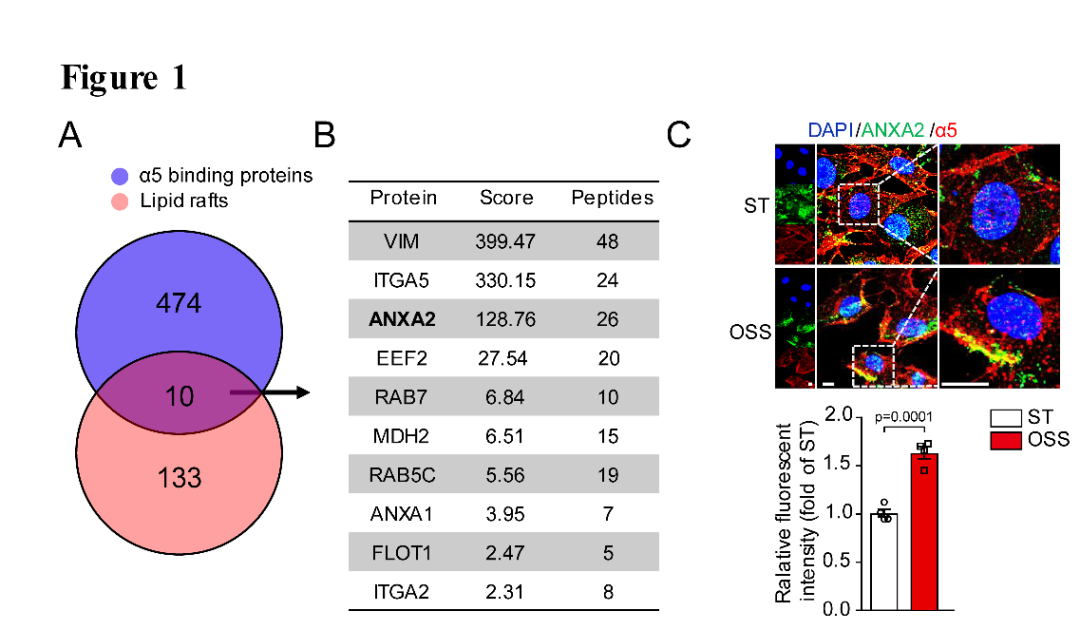
图1. 湍流促进ANXA2与integrin α5结合并脂筏转位
为了验证ANXA2对湍流介导的integrin α5转位以及内皮功能的影响,作者在内皮细胞中敲减ANXA2,发现湍流介导的integrin α5的脂筏转位明显减少(图2A-C),其下游靶基因p-FAK的表达受到抑制,内皮细胞的炎症因子VCAM-1,ICAM-1以及单核细胞的黏附显著降低(图2D-H),说明ANXA2介导湍流引起的integrin α5转位后激活以及内皮细胞的功能障碍。
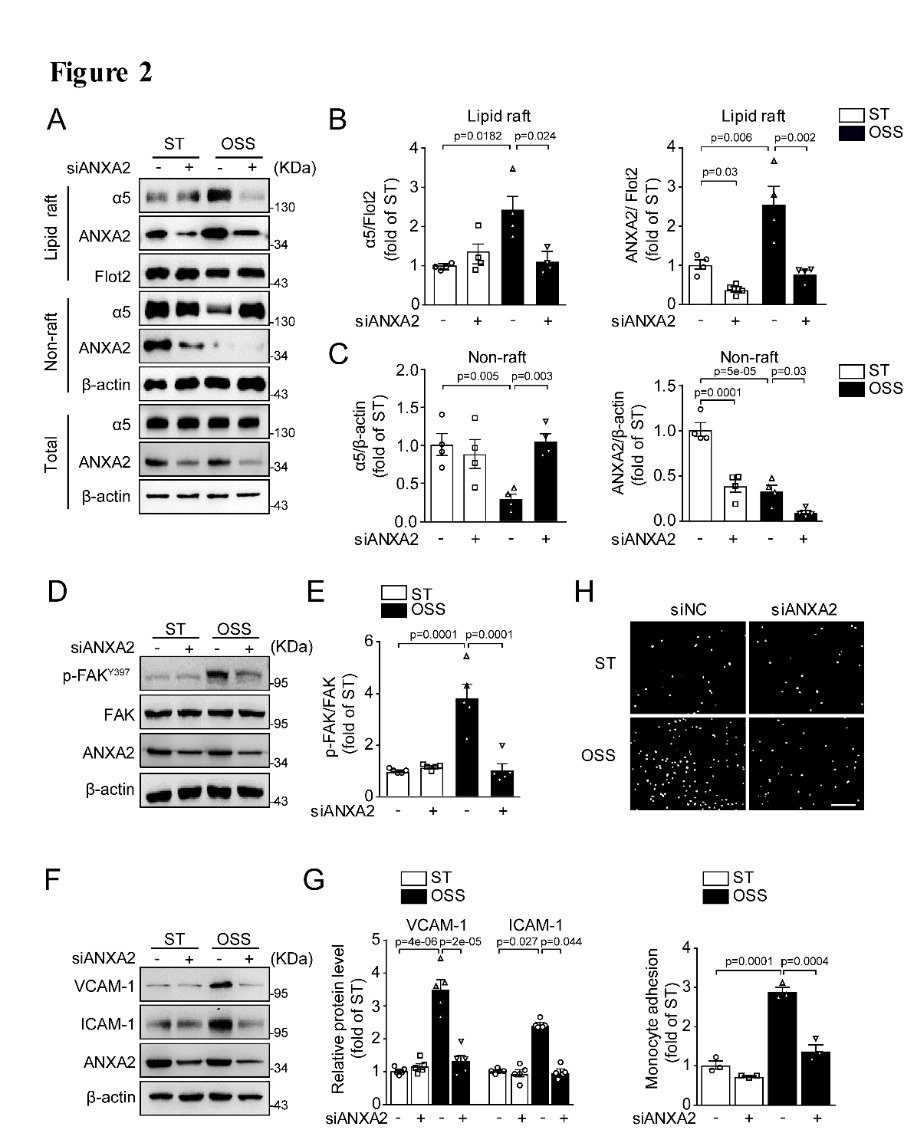
图2. ANXA2介导湍流引起的integrin α5转位激活及内皮功能损伤
作者发现integrin α5与ANXA2核心结构域C端的结合相比与全长ANXA2的结合明显增多,而且把integrin α5的胞内区替换成integrin α2的胞内区构建integrin α5/2嵌合体后,其与ANXA2的相互作用完全消失,说明ANXA2的C端与integrin α5的胞内区具有直接的相互作用(图3A,B)。
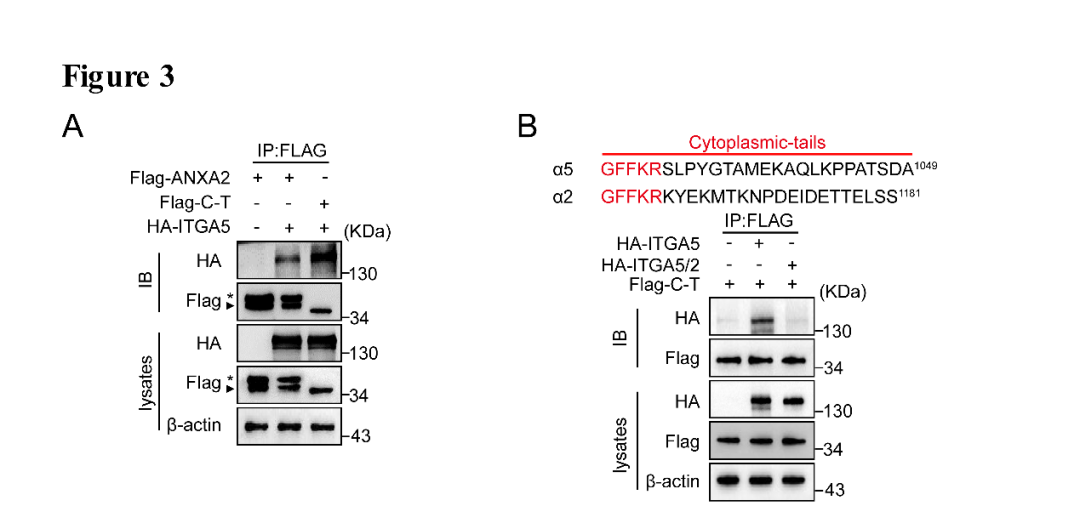
图3. integrin α5的胞质区与ANXA2的C端结合
ANXA2在静息状态下其N端(NTD)锚定在C端(CTD)的凹面形成一个蜷缩样结构,其构象会发生变化。那么N端与C端的结合是否会掩盖ANXA2与integrin α5的结合位点?基于内皮细胞易感染病毒的特性,作者合成了含有荧光基团的腺病毒来感染内皮细胞,并给予湍流刺激,生物发光能量共振转移(BRET)实验表明BRET比值明显降低,而且呈时间依赖性。提示ANXA2的N端从C端解离,导致了ANXA2的构象改变(图4A,B)。作者进一步证实了湍流通过抑制ANXA2酪氨酸24位点的磷酸化促使ANXA2构象打开,而且构建24位点突变失活的质粒明显增加ANXA2与integrin α5的相互作用(图4F)。
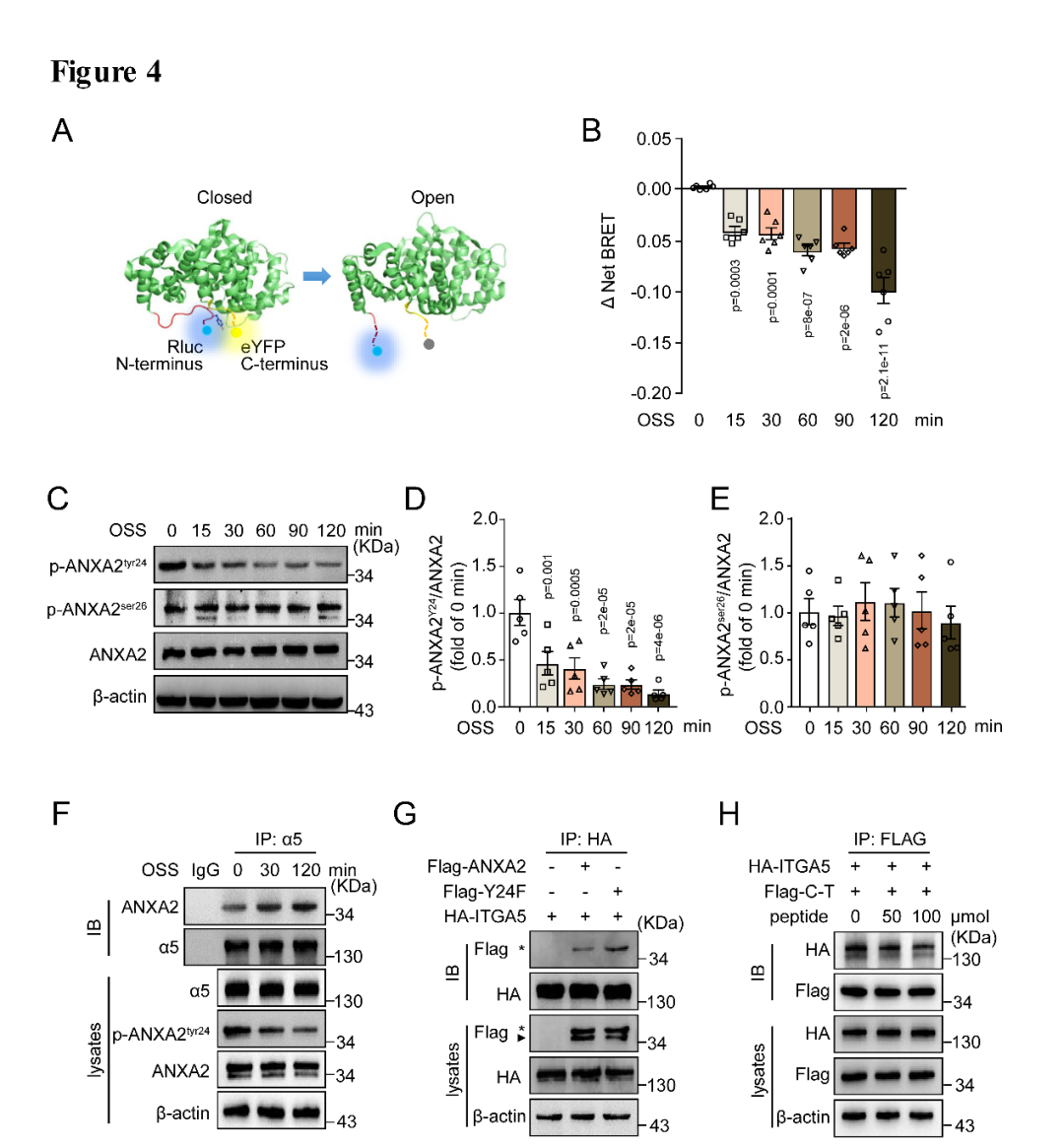
图4. 湍流通过调节ANXA2构象的变化增加与integrin α5的结合
为了研究ANXA2酪氨酸24位点在内皮中的功能,作者合成了ANXA2野生型慢病毒(lenti-AnxA2WT,吉凯基因提供), ANXA2酪氨酸24位点突变失活的(Y24F)慢病毒(lenti-AnxA2Y24F,吉凯基因提供)以及对照慢病毒(lenti-GFP)分别转染内皮细胞,然后给予湍流处理,Western Blot结果显示内皮细胞中转染lenti-AnxA2Y24F慢病毒后,其VCAM-1的表达相比于lenti-AnxA2WT细胞明显增加(图5A-B);在动物实验中,ApoE-/-小鼠行左颈总动脉部分结扎术来构建湍流模型,结果发现血管内膜转染lenti-AnxA2WT慢病毒能够明显促进结扎部位湍流引起的内膜integrin α5的激活(Act-α5)以及VCAM-1的表达, 转染lenti-AnxA2Y24F慢病毒的内膜相比于lenti-AnxA2WT其Act-α5以及斑块面积增加更加明显(图5C-F)。
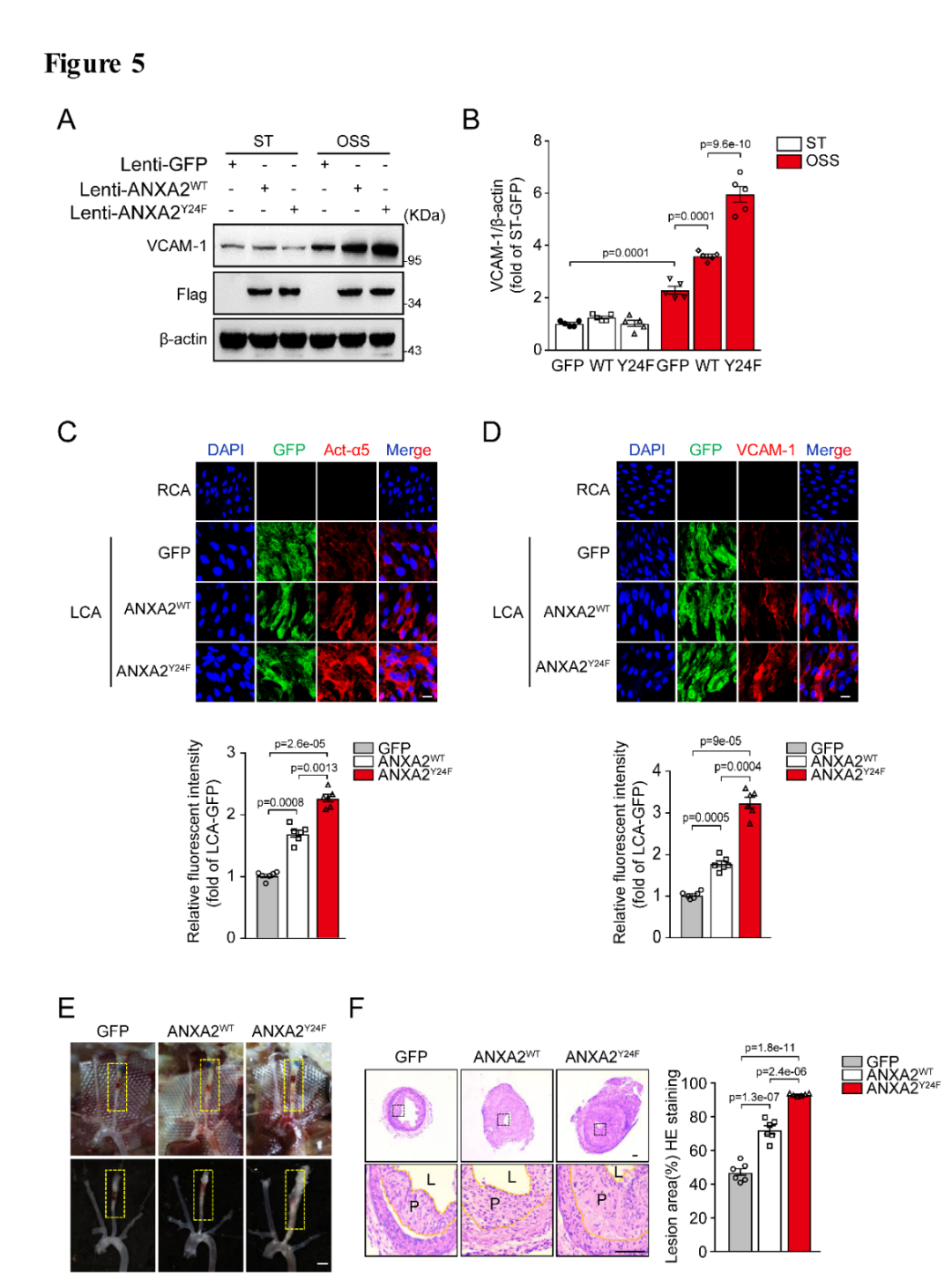
图5. ANXA2酪氨酸24位点去磷酸化介导内膜的激活
ANXA2作为钙离子依赖的磷脂结合蛋白,当细胞内钙离子增加时,ANXA2转位到细胞膜,进而定位到脂筏;而湍流又可以促进内皮细胞胞外钙离子内流,引起细胞内钙离子增多,诱发炎性信号反应。作者在内皮细胞中用钙离子载体A23187或者敲低机械钙通道Piezo1并给予内皮细胞湍流处理均能够影响p-ANXA2Y24以及p-FAK397的表达;Piezo1的特异性激动剂Yoda1也明显抑制p-ANXA2Y24的表达,增加了p-FAK397。说明湍流对于ANXA2磷酸化的调节依赖于Piezo1。(图6)
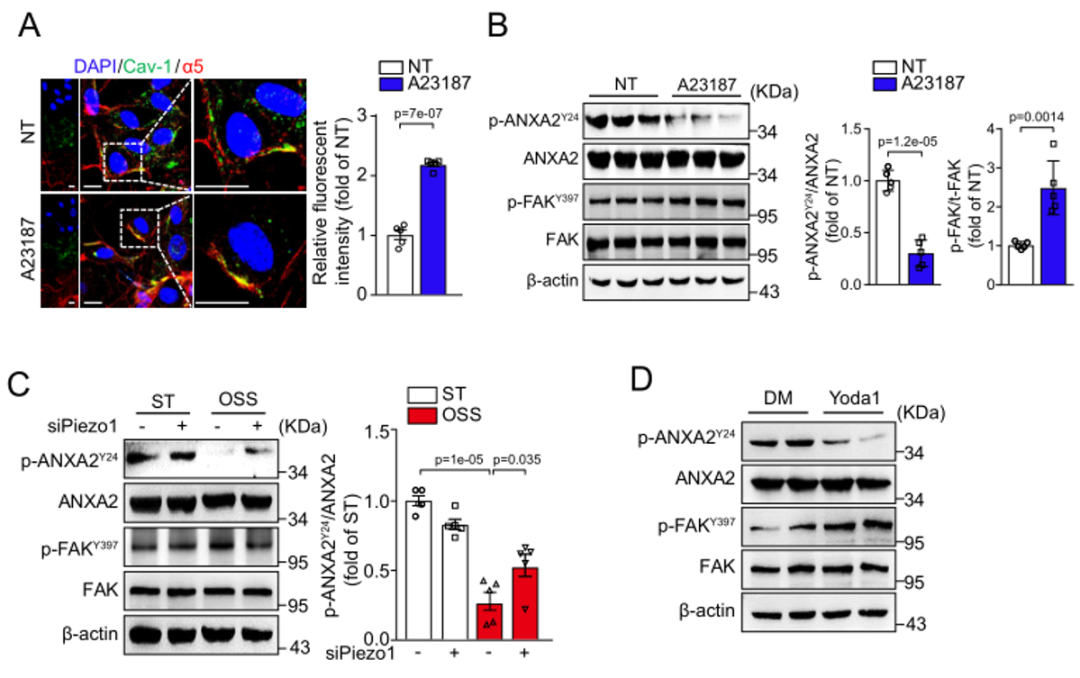
图6. 湍流引起的钙离子内流促进p-ANXA2Y24的去磷酸化依赖于piezo1
研究发现Piezo1-Ca2+对于ANXA2 酪氨酸24位点的去磷酸化具有重要的作用,而PTP1B是维一可以被 Ca2+/calpain剪切激活并发挥磷酸酶活性的酪氨酸磷酸酶,作者通过MALDI-TOF 发现ANXA2 酪氨酸24位点可以作为PTP1B特异性的底物(图7A);接下来作者敲低PTP1B或者使用PTP1B的抑制剂PTPi处理内皮细胞,然后给予湍流刺激或者Yoda1处理,结果发现均能够明显逆转ANXA2 酪氨酸24位点的去磷酸化水平,同时抑制了p-FAKY397的表达。(图7B-D)
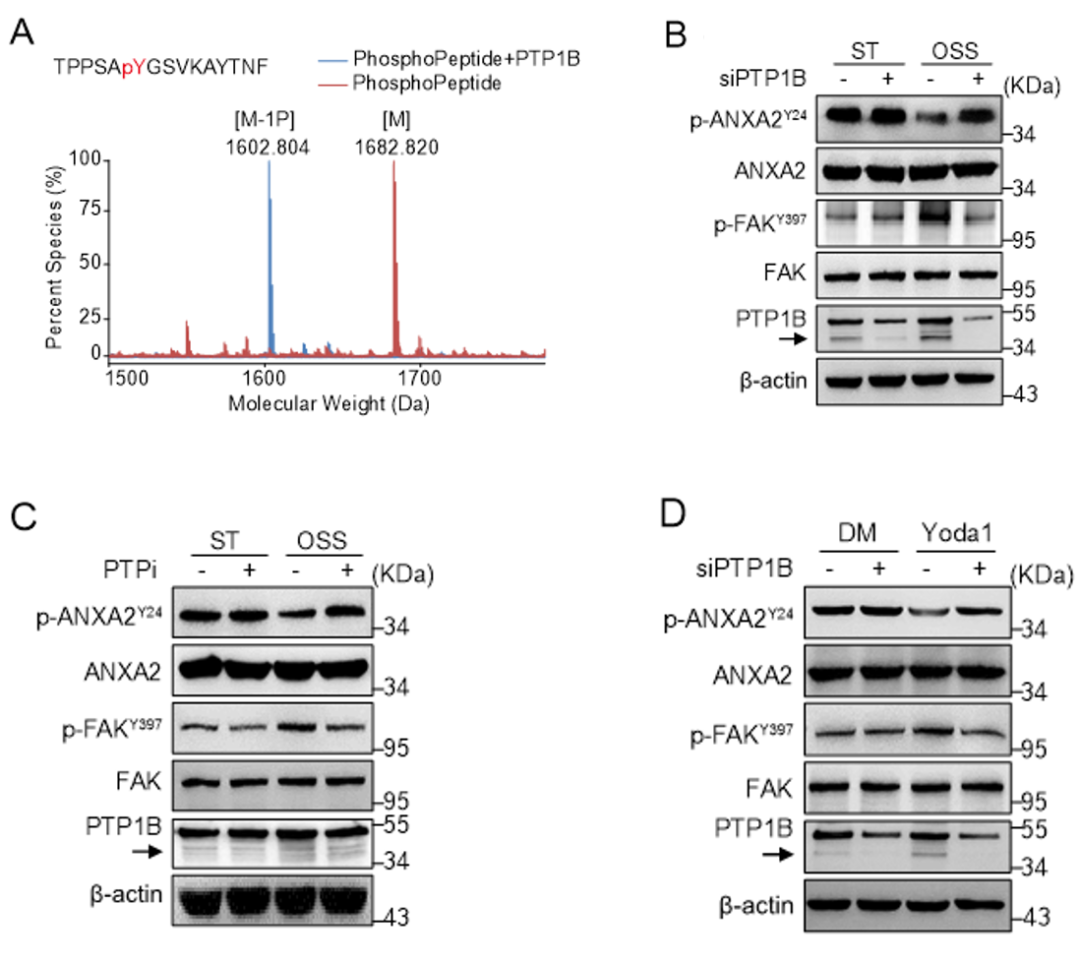
图7. PTP1B促进湍流诱导的ANXA2 酪氨酸24位点的去磷酸化
为了进一步研究PTP1B-ANXA2在血管内膜的功能,作者合成了PTP1B敲减的慢病毒(lenti-shPTP1B-GFP,吉凯基因提供)来感染血管内膜,Enface染色发现孵育lenti-shPTP1B-GFP慢病毒的左颈总动脉内膜中Act-α5及斑块面积的表达相比于对照组明显被抑制,而且对照组内膜中p-ANXA2Y24的表达在结扎部位明显减少,在孵育lenti-shPTP1B-GFP慢病毒后其表达明显增加(图8A-D);作者利用AnxA2-/-ApoE-/-双敲小鼠进行左颈总动脉部分结扎造模发现左侧颈动脉内膜中Act-α5的表达相比于ApoE-/-小鼠明显被抑制,而且孵育lenti-shPTP1B-GFP慢病毒的颈动脉中Act-α5的表达相比于lenti-shctrl-GFP并没有变化,同时Act-α5的表达明显减少;AnxA2-/-ApoE-/-小鼠的颈部斑块面积在PTP1B的敲减组及对照组并没有差别,提示PTP1B敲减后的抗动脉粥样硬化作用在AnxA2-/-ApoE-/-全敲后的到逆转(图8E-G)。
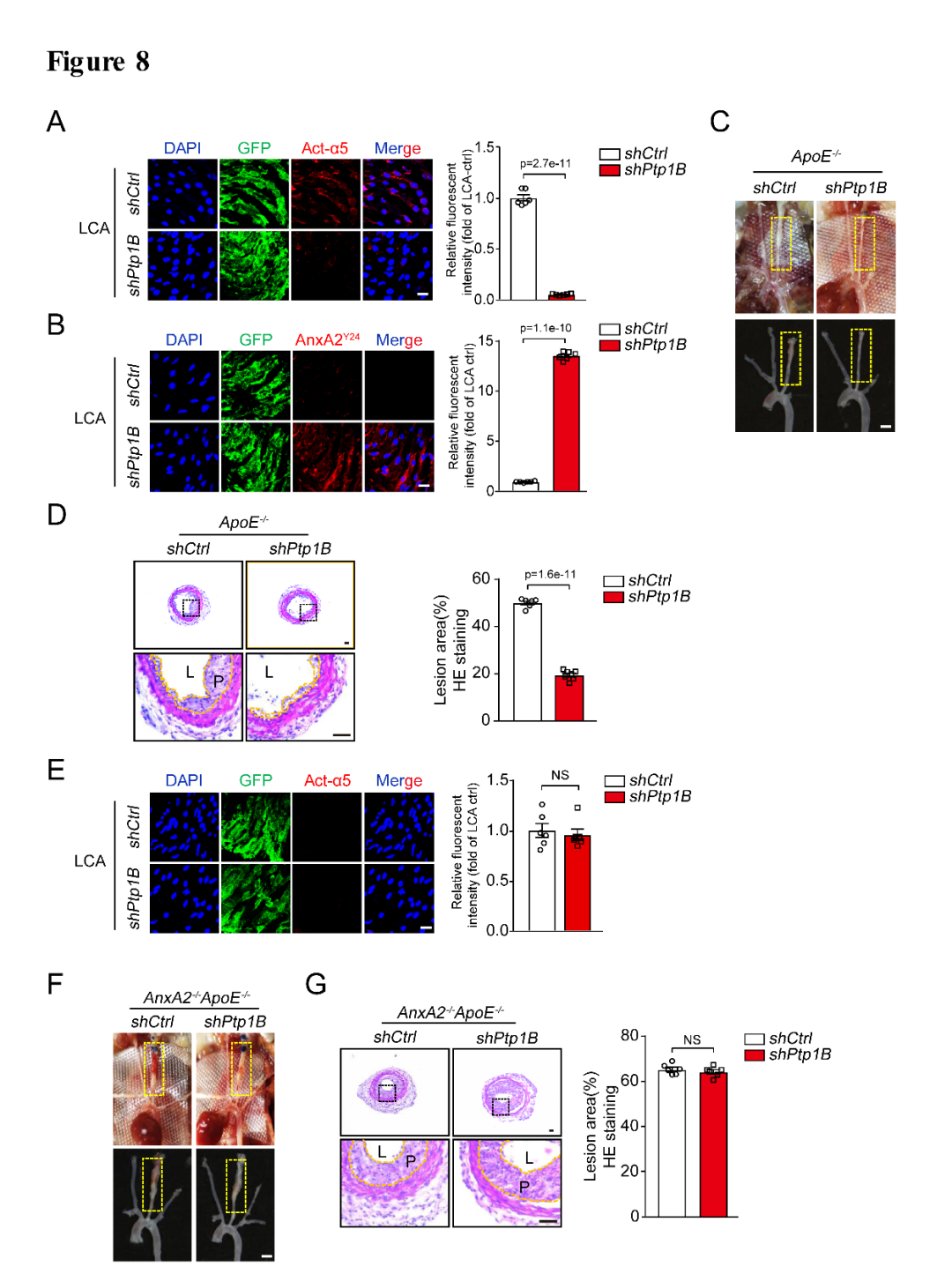
图8. 在体慢病毒敲低PTP1B影响integrin α5的激活
文章总结
1、ANXA2是协助integrin α5转位的靶蛋白;
2、ANXA2构象的改变影响了integrin α5的转位激活;
3、Piezo1-Ca2+-PTP1B-ANXA2信号通路调节integrin α5的激活及内皮功能障碍。
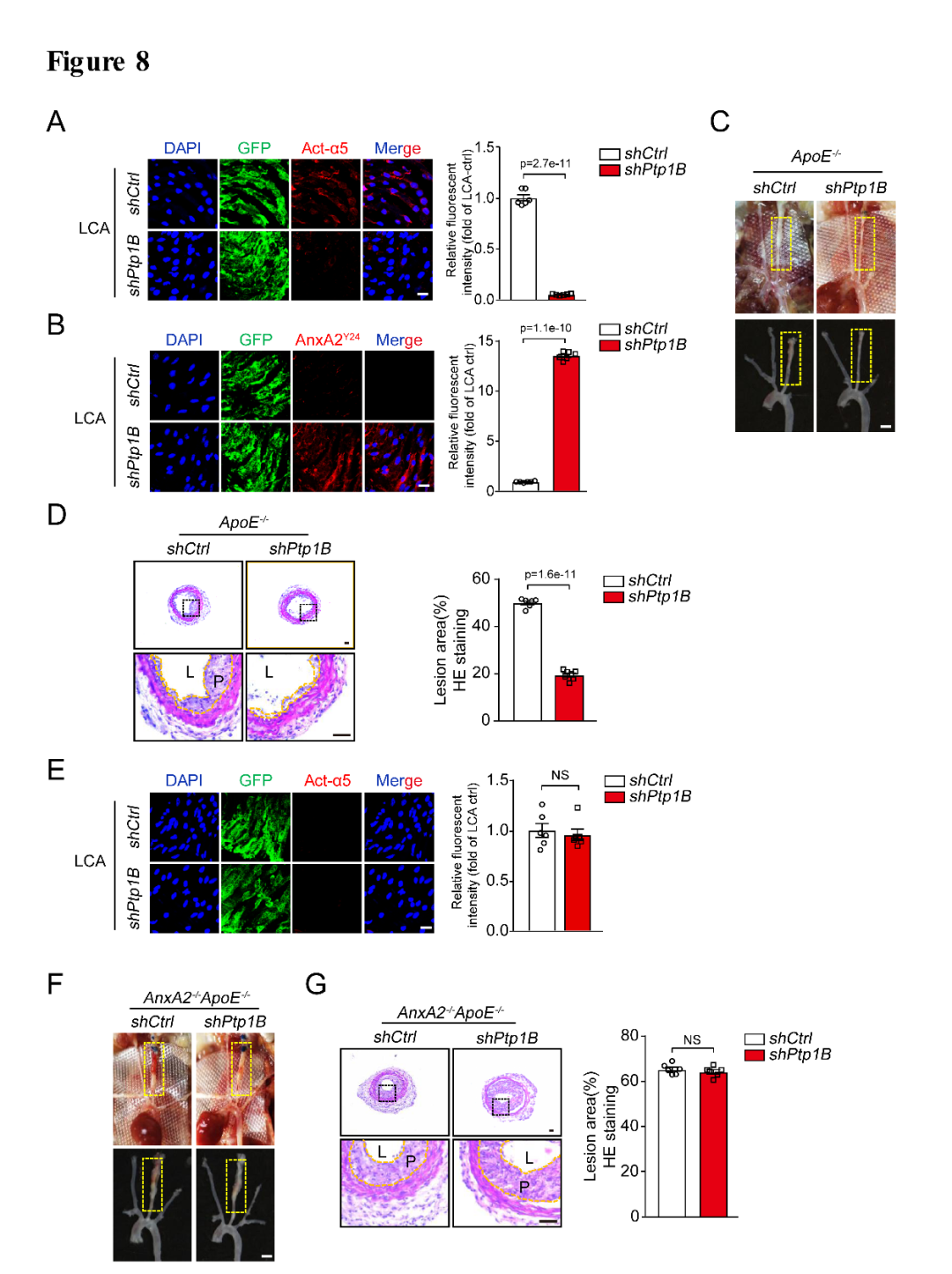
图9. 湍流通过Piezo1-Ca2+-PTP1B-ANXA2通路调控integrin α5激活及内皮功能障碍机制图
吉凯助力
本研究中所用到的Rluc-AnxA2-eYFP腺病毒, lenti-AnxA2WT慢病毒,lenti-AnxA2Y24F慢病毒, lenti-shPTP1B-GFP慢病毒(靶点序列为5’-CCGGCATGGAGAAAGGCTCGTTAAACTCGAGTTTAACGAGCCTTTCTCCATGTTTTTG3’)以及对照病毒(lenti-GFP)均由吉凯基因提供,分别感染内皮细胞及血管内膜,成功实现了蛋白的过表达或显著降低。
图10. Lenti-ANXA2-Y24F(MOI 10)感染内皮细胞HUVECs实现了ANXA2的Y24位点的沉默(A)以及PTP1B干扰慢病毒感染血管内膜实现了PTP1B基因的显著减低(B)
作者简介
天津医科大学基础医学院艾玎教授和朱毅教授为本文共同通讯作者,天津医科大学基础医学院博士研究生张成虎为本文第一作者。
艾玎教授
艾玎教授长期从事代谢性心血管疾病发病机制的研究。主要研究方向为代谢调节在心血管稳态维持中的分子机制及作用研究。从 2007 年至今,共发表研究论文和综述文章37篇,其中以第一或通讯作者身份发表研究性论文18篇,总IF为329,发表的全部论文被他引893次。围绕mTORC1、Hippo/YAP信号通路及脂代谢紊乱在动脉粥样硬化发生发展过程中的机制进行深入研究,以独立或共同通讯作者身份在J Clin Invest(2019)、Circ Res(2018及2014)及Hepatology(2016)等学术期刊发表4篇IF>10,3篇IF>5的研究性论文,并受邀撰写专业综述论文2篇(Br J Pharmacol 2017 J Diabetes 2016)。先后获得国家自然基金委优秀青年科学基金,青年学者以及国家杰出青年基金等项目的支持。
朱毅教授
朱毅教授在SCI期刊发表论文100余篇,总影响因子大于600,总引用次数2000余次。曾担任国家科技部“973”重大蛋白质项目首席科学家。现任中国病理生理学会副秘书长,国际心脏研究会(ISHR)中国分会主席,中国生理学会循环专业委员会副主委,中国生物化学与分子生物学会脂蛋白专业委员会常务委员,《Frontiersin Vascular Physiology》的副主编,Arterio Thromb Vasc Biol、Journal of Diabetes、《中华病理生理学杂志》、《生理科学进展》等杂志的编委。
更多活动火热 · 进行中
RNAi 5保2 慢病毒
满足高分文章发表需求
即可领取“6折”优惠券
仅50个名额哦!