上海吉凯基因医学科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
不止安全!新光控、热控 CAR-T 策略,为实体瘤治疗破局!
208 人阅读发布时间:2025-11-10 17:42
CAR-T治疗我们都不陌生,主要的治疗流程简单来说就是患者的外周血中分离单个核细胞,进一步将T细胞分离,将T细胞激活之后通过慢病毒载体将T细胞转入CAR,CAR-T细胞扩增之后,将CAR-T细胞回输患者体内。
回顾CAR-T技术的发展历程:
-
20世纪90年代,第一代CAR仅包含CD3ζ胞内信号域
-
2000年左右,第二代CAR引入一个共刺激信号域
-
2010年以来,第三代CAR进一步增加了双共刺激结构域
如今,CAR结构设计不断革新,展现出日益广阔的应用前景。下面通过两篇前沿文献,介绍新的CAR设计突破。
1 纳米光遗传技术实现无线精准调控的LiCAR-T疗法
这篇文献利用纳米光遗传学技术实时体外无线操控光敏感嵌合抗原受体T细胞(LiCAR-T),实现了安全精准的细胞免疫疗法。

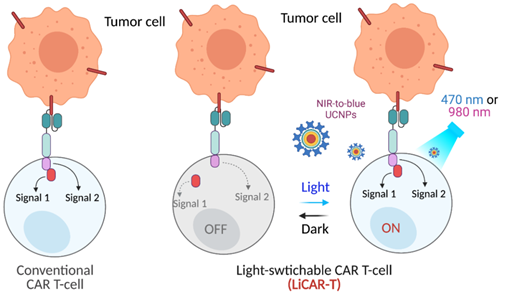
技术原理
光可开关CAR(LiCAR)是通过细胞内分裂CAR的功能域并将光响应模块安装到分开的CAR的每一半中来设计。然后通过将光学二聚体与细胞外抗原结合模块或源自常规 CAR 的细胞内信号转导模块融合,生成了一系列混合构建体。
实验证实:基于 CRY2 和 LOV2 的 LiCAR为理想组合。因此,LiCAR T 细胞表现出光依赖性激活,表明使用光微调 T 细胞激活程度的可行性。
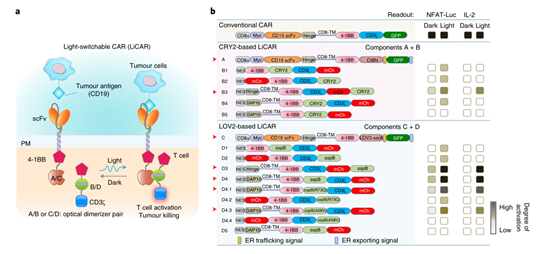
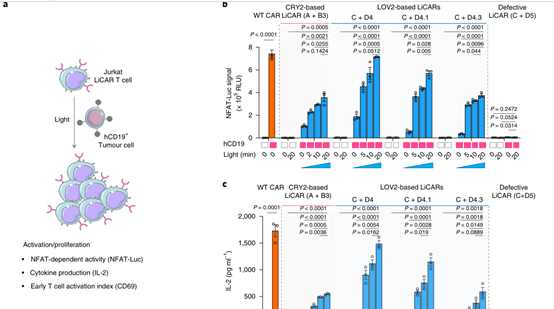
实验验证
在后期的细胞杀伤实验中表明,LiCAR-T 细胞能够在肿瘤抗原和光的双重存在下对同源靶细胞产生抗肿瘤细胞毒性。
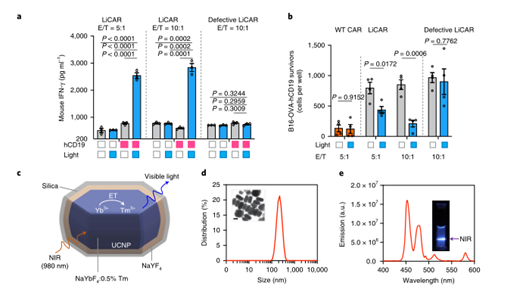
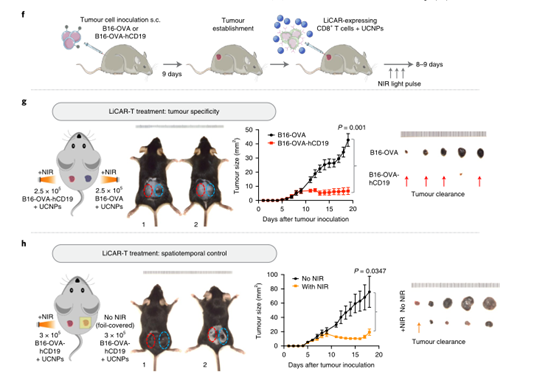
此外,为了证明体内无线光遗传免疫治疗的可行性,研究人员进一步将 LiCAR T 细胞与可手术移除的上转换纳米板 (UCNP) 相结合,这些纳米板具有增强的近红外 (NIR) 至蓝色上转换发光。UCNPs 作为微型光传感器,在深组织可穿透近红外光的刺激下,使活体动物的 LiCART 细胞能够诱导激活。这种 NIR 光可调纳米光遗传学平台能够时空控制 CAR-T 细胞介导的针对血液系统恶性肿瘤和实体瘤的细胞毒性,并具有定制的剂量和持续时间,从而大大减轻与当前免疫疗法相关的副作用。
2 聚焦超声技术实现肿瘤局部热控CAR-T疗法
这篇文献将聚焦超声(FUS)与嵌合抗原受体T细胞(CAR-T cells)疗法相结合,可以在保护正常组织的同时摧毁恶性肿瘤。

技术设计
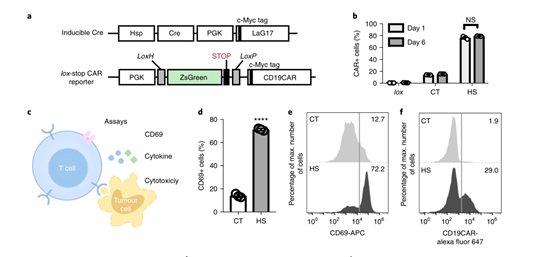
研究团队构建了一个包含热休克蛋白(Hsp)启动子的载体,这种载体在局部热诱导(43℃)下可以持续稳定表达。当团队使用聚焦超声时,超声波转换的热能激活热休克蛋白表达后,CAR-T 才可以被启动,进而可以控制 CAR-T。
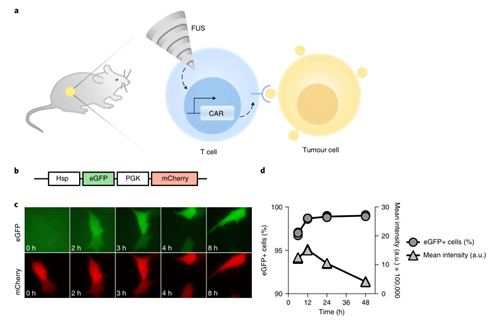
研究团队将 Cre–lox 基因开关整合到热诱导系统中,以在加热条件下表达针对 CD19 阳性肿瘤细胞的嵌合抗原受体(CD19CAR)。
接下来他们研究了热诱导表达的 CD19CAR 在细胞中的功能。将 热诱导工程化 Jurkat 细胞(即热诱导的 CD19CAR-T 细胞)与表达 CD19 的 Nalm-6 肿瘤细胞共培养 24 小时,他们发现加热诱导了 T 细胞的早期活化。细胞毒性试验显示热诱导 T 细胞的肿瘤细胞毒性随着 E : T(effector-to-target)比率的增加而增加,证实了热诱导的 CAR-T 细胞获得了杀伤癌细胞的能力。
MRI 引导的 FUS 能够在局部区域范围内传递热能,研究团队将 FUS 系统与 7T 磁共振技术结合,用慢病毒双荧光素酶报告基因转染 Nalm-6 细胞,并将细胞嵌入一定深度的模具中。通过调整超声波焦距,将超声波聚焦在嵌入的细胞上。
三次 5 分钟的 FUS 刺激脉冲可显著诱导基因表达,诱导水平与使用具有相同加热模式的热循环器的阳性对照相当, 表明该方法可以高效地声学控制工程细胞中的基因激活。
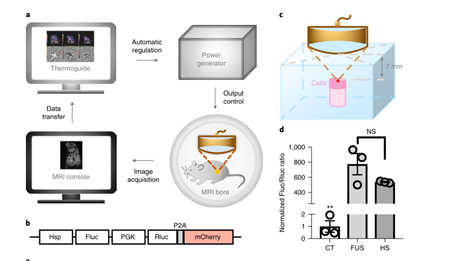
接着,他们使用 MRI 引导的 FUS 控制体内的局部温度,并在小鼠体内使用 Nalm-6 细胞和双荧光素酶报告基因判断 FUS 诱导的基因激活。结果显示, 仅用两次 5 分钟 FUS 刺激即可在注射细胞中观察到显著的基因诱导表达。
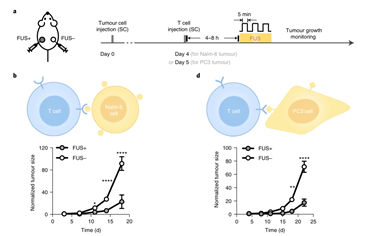
这些新的CAR分子的设计在体内和体外对CAR-T细胞的调节都证明非常有效。不论是光控还是热控制的系统都将有助于提高 CAR-T 的安全性,为进一步安全有效的CAR-T细胞应用提供了新的技术储备,具有临床应用的前景。
参考文献:
[1].Nguyen NT, et al Nano-optogenetic engineering of CAR T cells for precision immunotherapy with enhanced safety. Nat Nanotechnol. 2021 Dec;16(12):1424-1434.
[2]. Wu Y, et al. Control of the activity of CAR-T cells within tumours via focused ultrasound. Nat Biomed Eng. 2021 Nov;5(11):1336-1347.