上海吉凯基因医学科技股份有限公司品牌商
14 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
公司新闻/正文
组织特异性干扰怎么做——基于miRNA骨架设计shRNA
1966 人阅读发布时间:2020-08-24 15:39
RNAi介导的基因沉默已经被广泛应用于基因功能的研究。通常用于诱导持续的RNAi的手段,是用三型启动子持续表达shRNA。目前常用的三型启动子有U6和H1。这类启动子的优势在于他们可以控制shRNA的高水平表达,从而介导有效沉默。并且,通过三型启动子起始shRNA表达,构建序列较短,能够被轻易地插入病毒载体。但这类启动子也有一定的限制,首先就是缺少细胞和组织特异性;其次,高水平的shRNA表达有增加脱靶效应的风险,也可能导致细胞毒性1。
目前,越来越多的动物实验需要对某个组织进行特异性的基因表达调控。但受限于U6和H1缺乏组织特异性,我们需要一种新的方法来实现,比如利用二型启动子起始转录的miRNA结构,来表达shRNA。
miRNA的成熟过程与shRNA非常类似,不过多了一步在核内的加工过程。长度可达几kb的Pri-miRNA被Drosha加工形成70bp左右的Pre-miRNA。不同于shRNA二聚体完全互补的发卡结构,miRNA在被Dicer切割后形成的二聚体不完全互补(图1)。并且,大部分miRNA被Dicer切割产生的双链RNA往往只有一条链参与形成RISC。
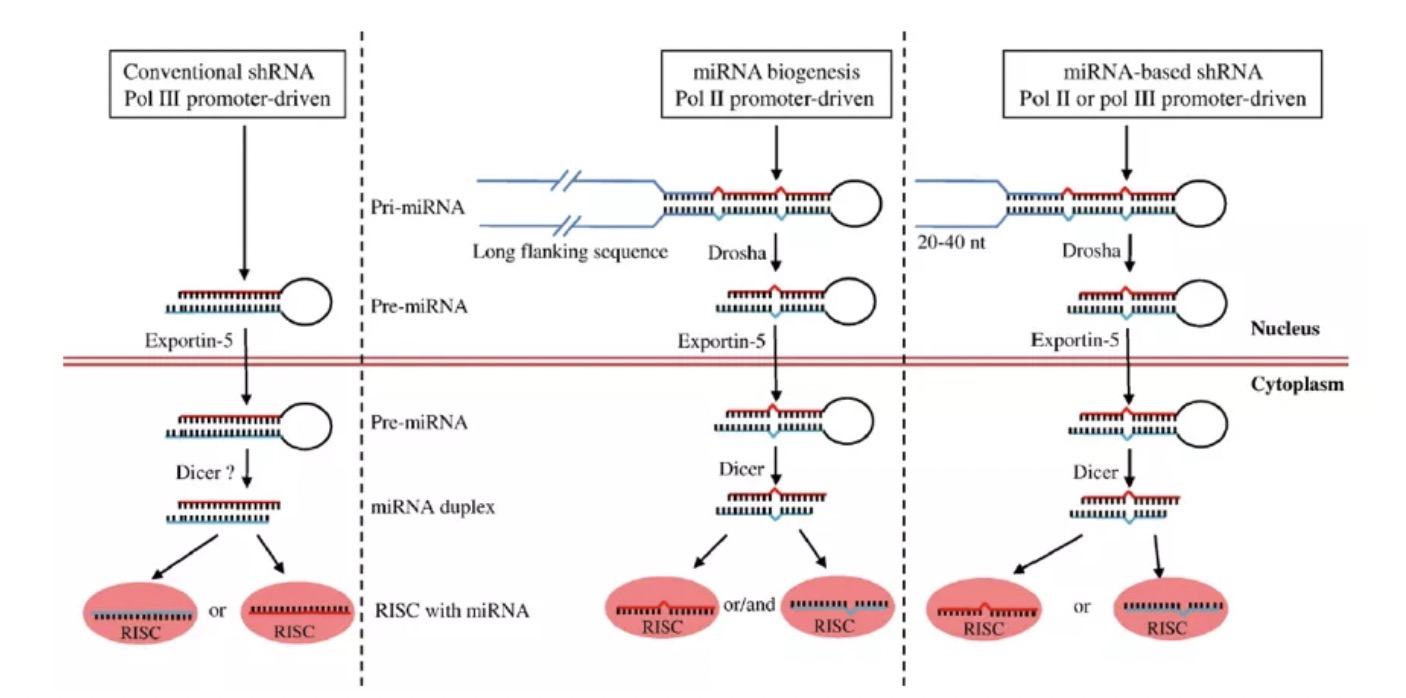
图 1
miRNA调节基因表达主要有两种方式,一种是成熟的miRNA是和目的mRNA完全互补结合,然后切割降解mRNA;另外一种是成熟的miRNA和目的mRNA不完全互补,此时一般是结合在该转录本的3‘UTR区域,抑制转录(图2)。因此,除去常规的shRNA设计方式,还有一种shRNA设计方式是基于miRNA的结构进行设计。
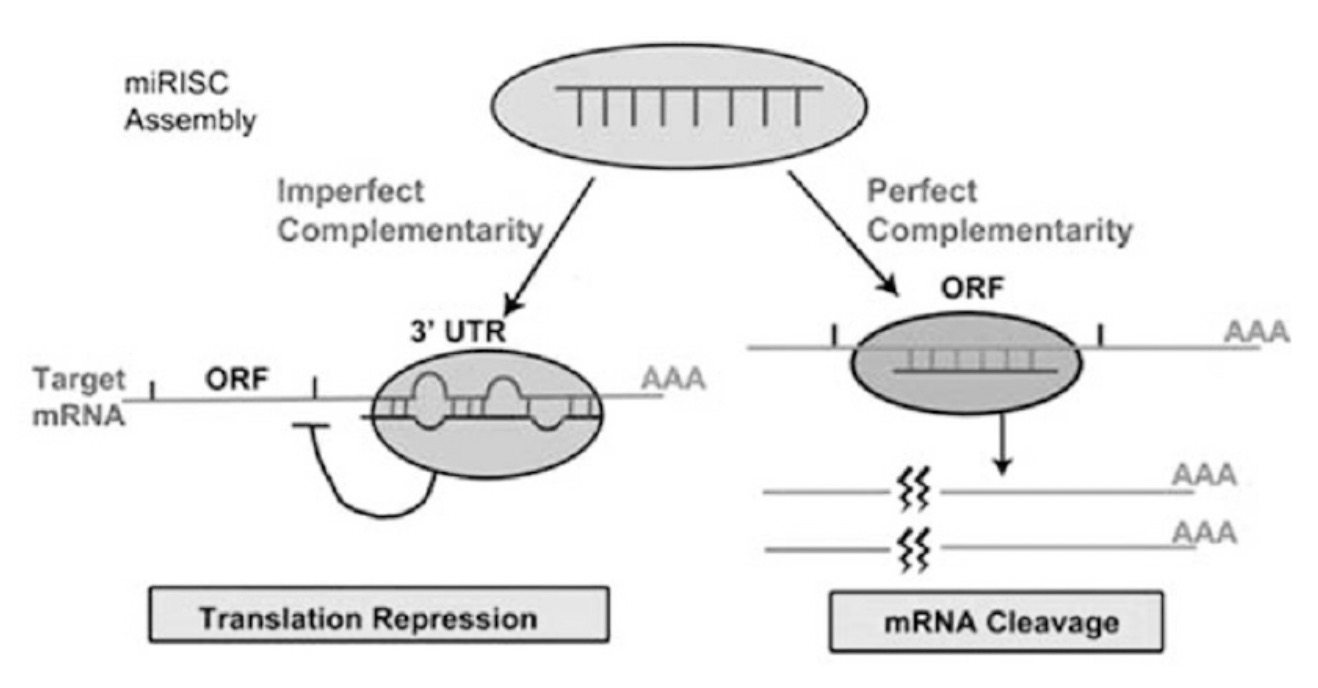
图 2
具体的设计方案是将某个miRNA的5’ flanking region和3’flanking region及loop区域的序列保留,然后将miRNA成熟区域的序列替换成靶点序列,这里3’snese靶点序列往往会删除部分碱基使其与5’antisense不完全互补(图3)。

图 3
当然,并不是所有的miRNA采用这个设计方案都可以有效干扰目的基因,目前常用的miRNA骨架是miR-30和miR-155,而比如基于miR-27、let7a3和lin-4骨架的靶点均被报道无法有效地干扰目的基因2。基于miRNA骨架设计的shRNA同常规shRNA的一个很大区别在于,它可以采用二型启动子来起始转录,从而实现对某个组织进行特异性的基因下调。
一般而言,AAV干扰病毒需要先在体外进行筛选确认有效靶点,再进入在体的研究。但使用特异性启动子筛选的难点在于,它们仅在某一种特定的细胞类型中表达,很难在常用的工具细胞(如293T细胞)中开展筛选工作。为了解决这个难题,吉凯目前正在推出特异性启动子的AAV干扰靶点筛选服务,整个实验流程可以参考图4。
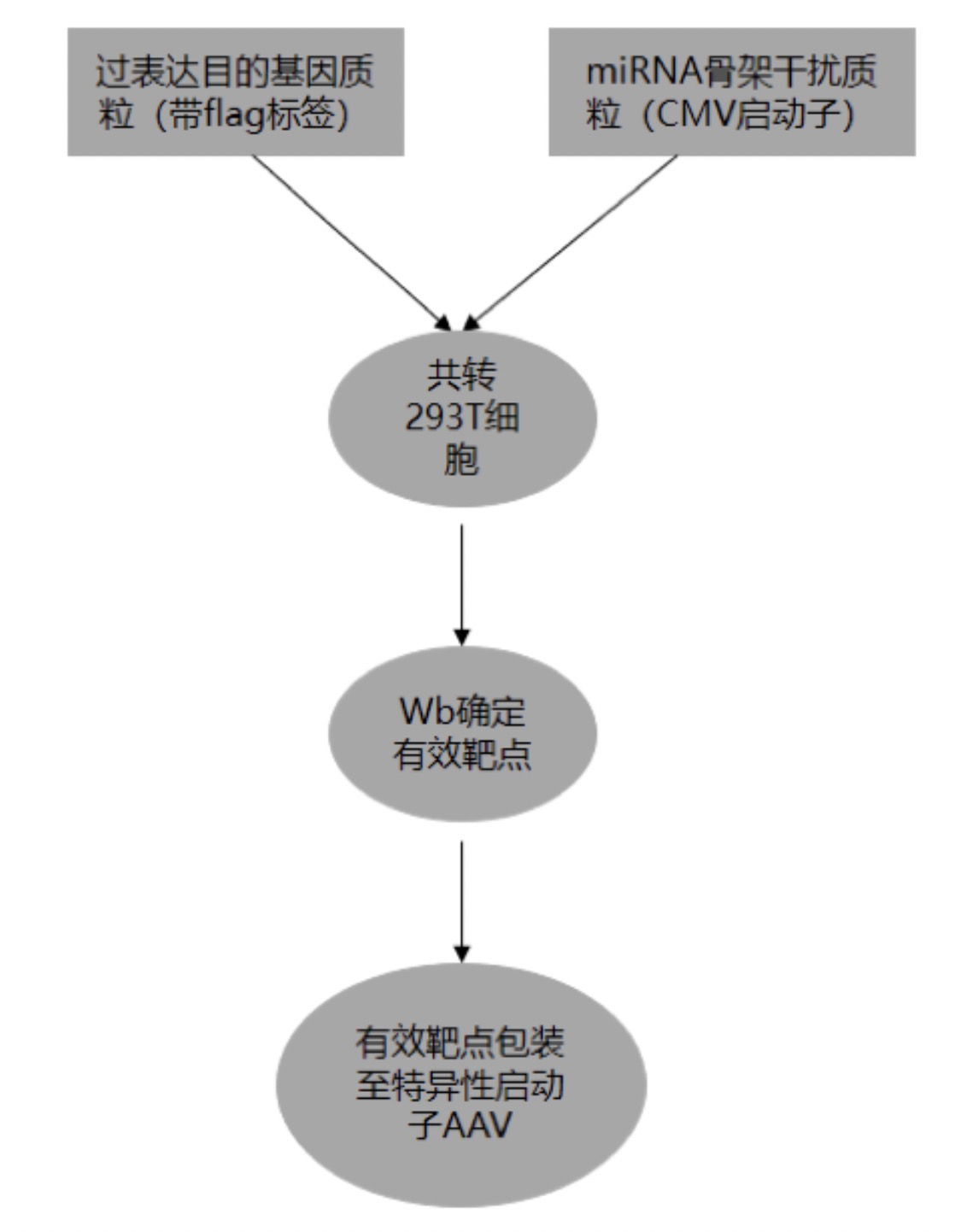
图 4
如果有对这方面的内容比较感兴趣,欢迎扫码添加客服垂询。

组织特异性AAV载体是一款更精准、更高效的基因操作工具;解决了“在体实验基因调控的特异性问题;并且结合AAV血清型实现靶向感染与特异性启动子靶向转录”。
已被广泛应用于神经、内皮、肌肉、骨骼、心血管、眼科、肝脏、肾脏、脂肪、胰腺、视网膜穆勒细胞、小胶质细胞等多个研究领域。
吉凯基因共提供30余种不同器官的特异性启动子AAV载体,如您想既能高效感染,还能靶向调控,选择组织特异性AAV载体 ——2-6周即可实现不同组织的特异性表达!
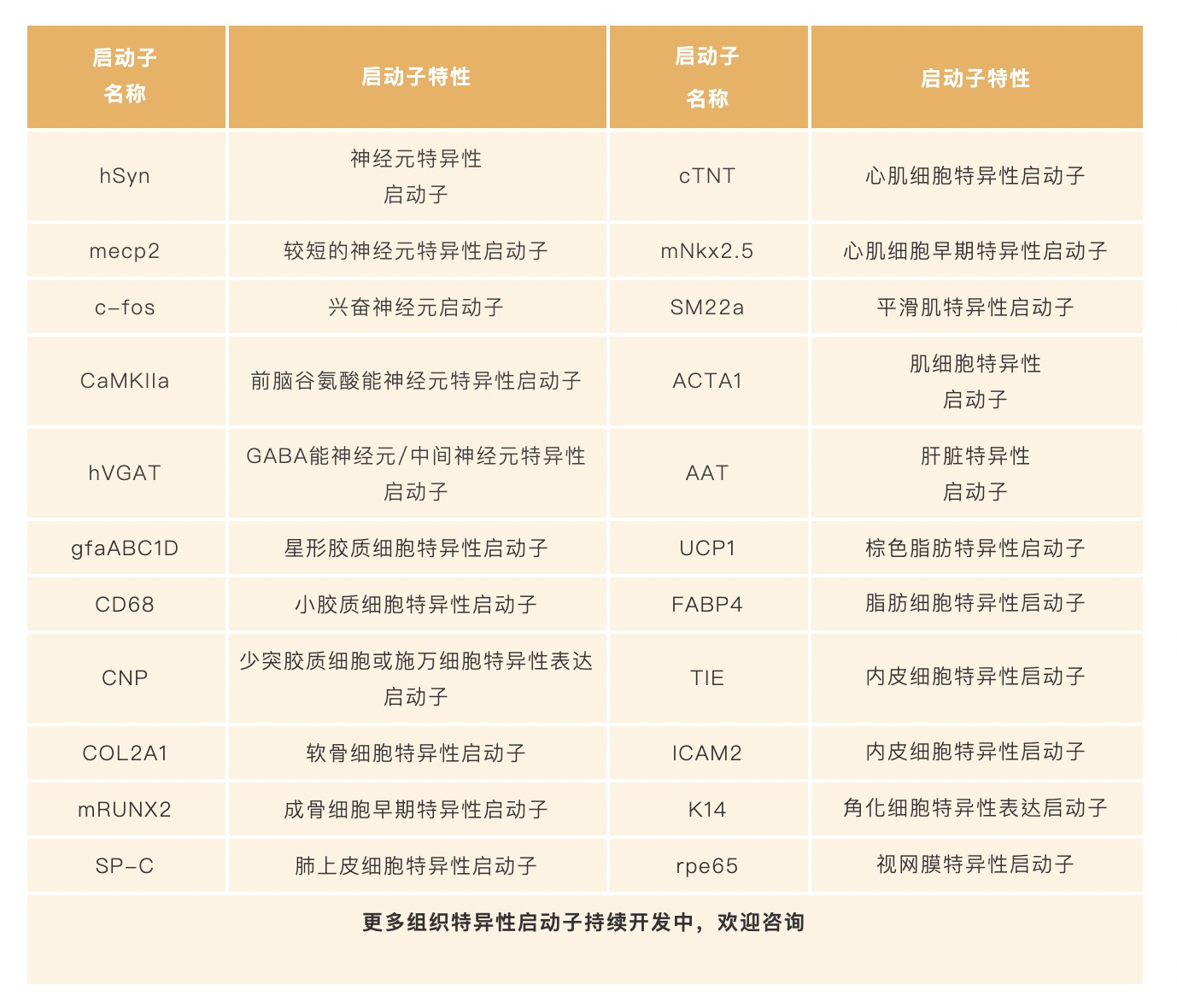
点击了解学习更多关于
【参考文献】
1. D. Grimm, K.L. Streetz. Fatality in mice due to oversaturation of cellular microRNA/
short hairpin RNA pathways (2006). Nature. 441: 537–541.
2. N Manjunath , Haoquan Wu. Lentiviral Delivery of Short Hairpin RNAs (2009). Adv Drug Deliv Rev. 61(9):732-45.