上海吉凯基因医学科技股份有限公司品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
公司新闻/正文
乳酸化×乙酰化:微管α蛋白细胞骨架功能的代谢调节
1058 人阅读发布时间:2025-09-11 09:50

微管是细胞骨架的主要组成部分,由α/β-微管蛋白异二聚体构成,在真核细胞中形成管状结构。微管具有高度动态性,通过持续的聚合与解聚过程执行多种功能,包括细胞内物质运输、细胞分裂和细胞迁移。微管蛋白的翻译后修饰在特化微管结构中高度富集,可在特定位点调控微管动态性。α-微管蛋白的40位赖氨酸(K40)的乙酰化修饰是稳定微管的标志物。α-微管蛋白的乙酰化修饰由乙酰转移酶 MEC17/α-TAT1 催化,且可被去乙酰化酶 HDAC6 Sirt2去除。乳酸化修饰可靶向组蛋白与非组蛋白的赖氨酸残基。研究表明,p300 或 TIP60 等乙酰转移酶可利用乳酸辅酶A(Lac-CoA)作为供体,催化蛋白质的乳酸化修饰。HDAC 家族蛋白与去乙酰化酶(Sirtuins)被发现可去除蛋白质的乳酸化修饰。同时,缺氧环境与糖酵解增强可提高多种细胞中蛋白质的乳酸化水平。然而,蛋白质乳酸化的调控机制仍不明确。
2024年8月,来自上海科技大学的研究团队在Nature Communications上发表Metabolic regulation of cytoskeleton functions by HDAC6-catalyzed α-tubulin lactylation文章,首次发现α-微管蛋白(α-tubulin)的K40赖氨酸位点存在乳酸化修饰,且这一修饰由已知的α-微管蛋白去乙酰化酶HDAC6以乳酸为供体催化(打破其仅作为去乙酰化酶的传统认知),该过程具有乳酸浓度依赖性且依赖 HDAC6的去乙酰化活性,α 微管蛋白K40乳酸化与乙酰化竞争同一位点。
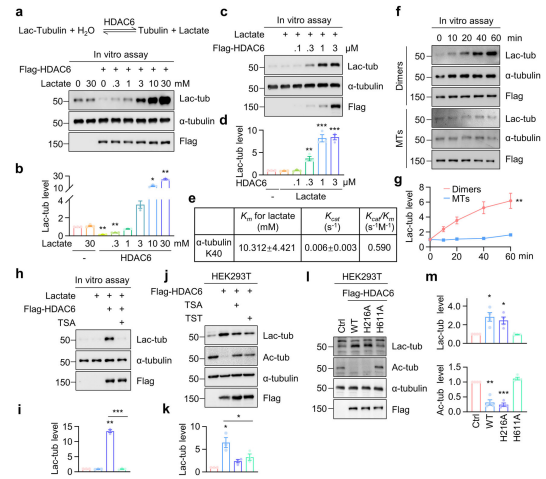
01 鉴定α-微管蛋白K40赖氨酸乳酸化修饰及主要乳酸转移酶HDAC6
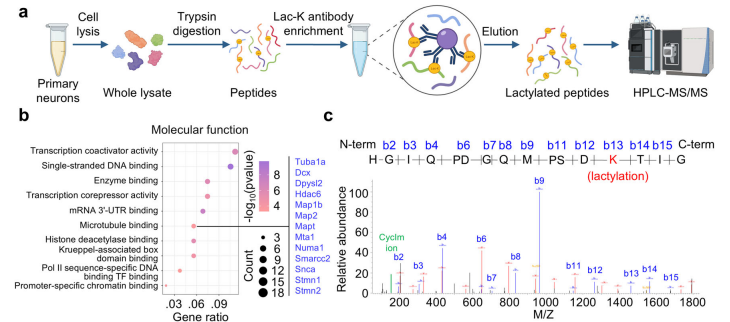
利用抗赖氨酸乳酸化(lac-K)抗体富集乳酸化肽段,并进行质谱,共有 285 个肽段发生乳酸化修饰,α-微管蛋白肽段的K40赖氨酸可能发生乳酸化修饰。免疫印迹、α- 微管蛋白 K40 位赖氨酸突变体构建等证明K40是α-微管蛋白的主要乳酸化修饰位点。将多种乙酰转移酶转染至HEK293T细胞,发现过表达HDAC6 可显著提高α-微管蛋白的乳酸化水平,且乳酸化发生在K40位点。在缺乏α-微管蛋白乙酰化修饰的MEC-17敲除细胞中,过表达HDAC6 仍可提高α-微管蛋白的乳酸化水平,提示HDAC6诱导的α-微管蛋白乳酸化修饰不依赖于α-微管蛋白的乙酰化修饰。
02 HDAC6的乳酸浓度依赖性及去乙酰化活性,是α-微管蛋白乳酸化修饰代谢调控所必需
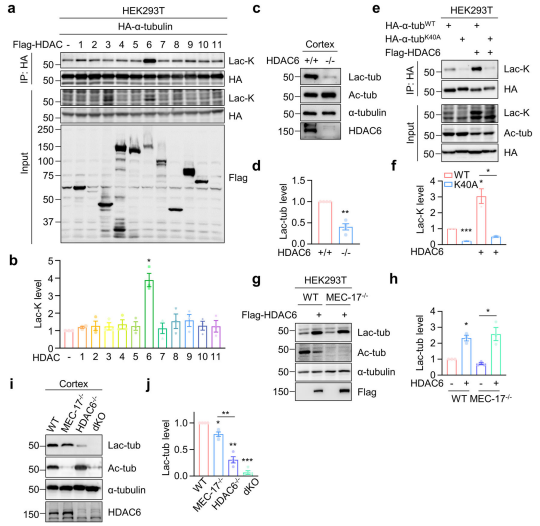
纯化Flag-HDAC6蛋白,并在不同乳酸浓度下将其与微管蛋白共同孵育发现,乳酸浓度低于1mM时,HDAC6表现出去乳酸化酶活性;而当乳酸浓度高于1 mM时,HDAC6则促进α-微管蛋白的乳酸化修饰,表明HDAC6 通过依赖乳酸浓度的可逆反应催化α-微管蛋白的乳酸化修饰。HDAC6包含两个去乙酰化结构域,对两个去乙酰化结构域中负责去乙酰化活性的关键位点(分别为第一个结构域的组氨酸H216和第二个结构域的组氨 H611)进行突变,发现H611突变可破坏 HDAC6 催化 α- 微管蛋白乳酸化修饰的活性,而H216 突变则无此效应,表明HDAC6 的去乙酰化活性对其乳酸化活性至关重要。
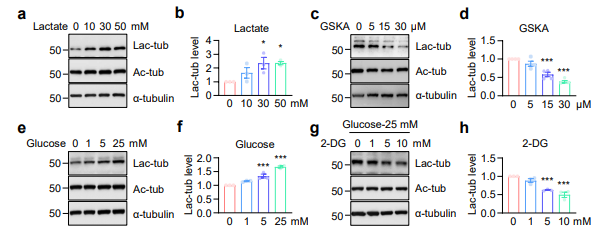
高乳酸浓度可触发HDAC6催化α-微管蛋白的乳酸化修饰,而糖酵解途径可产生乳酸,推测糖酵解可能提高α-微管蛋白的乳酸化水平,并通过不同浓度葡萄糖处理HEK293T细胞得到验证。免疫印迹结果显示,HDAC6敲除细胞中,乳酸无法诱导α-微管蛋白的乳酸化修饰。糖酵解通过HDAC6催化的乳酸化反应调控 α-微管蛋白的乳酸化修饰。
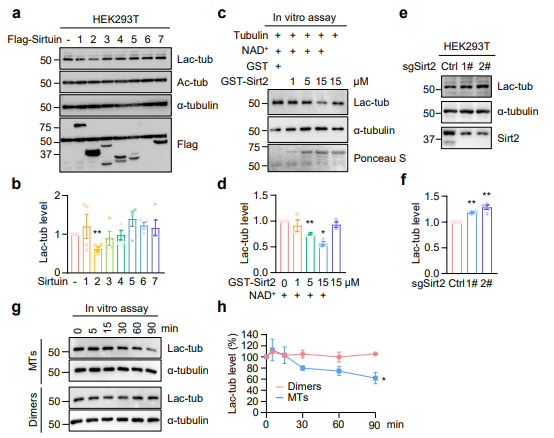
03 Sirt2作为α-微管蛋白的去乳酸化酶
研究表明,去乙酰化酶(Sirtuin)家族蛋白可去除蛋白质的乳酸化修饰。对 Sirtuin 家族蛋白进行筛选,发现过表达Sirt2可降低α-微管蛋白的乳酸化水平。体外实验发现,Sirt2敲除细胞中α-微管蛋白的乳酸化水平升高,当Sirt2与微管共同孵育时,α-微管蛋白的乳酸化水平较其与微管蛋白二聚体共同孵育时显著降低,提示Sirt2催化α-微管蛋白去乳酸化修饰时优先选择微管作为底物。
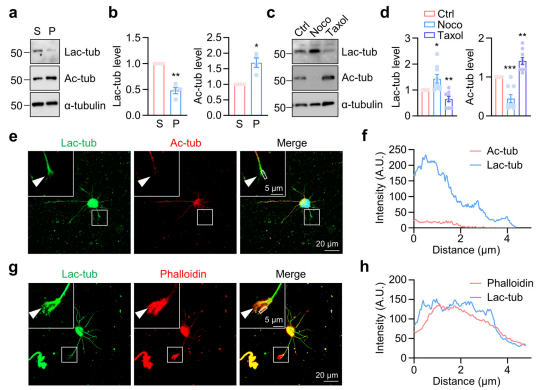
04 α-微管蛋白乳酸化修饰的定位及在微管中的作用
分离 HEK293T细胞中的可溶性微管蛋白二聚体(S)与聚合微管(P),结果显示,乳酸化α-微管蛋白主要存在于可溶性组分中,这可能源于HDAC6对微管蛋白二聚体的底物偏好。α- 微管蛋白的乳酸化修饰是可溶性微管蛋白二聚体的标志物,而同一位点的乙酰化修饰则是稳定微管的标志物。纯化微管蛋白,通过体外乳酸化实验、微管重组实验等发现,乳酸化α-微管蛋白可促进微管蛋白成核并增强微管动态性。
利用EB3-tdTomato标记微管正极,通过时间序列成像观察体外培养第3天(DIV3)海马神经元中微管的动态性,发现乳酸处理可显著增加轴突中EB3彗星的数量并提高其移动速度,表明α-微管蛋白的乳酸化修饰可能通过增强神经元中微管蛋白的成核过程,增加生长微管的数量。α-微管蛋白的乳酸化修饰可增强培养神经元中微管的动态性,在调控神经元发育与神经突生长中发挥重要作用。
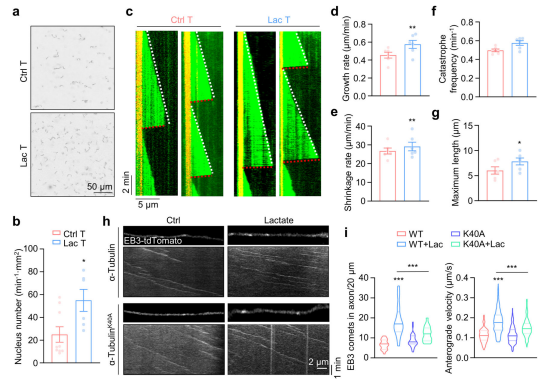
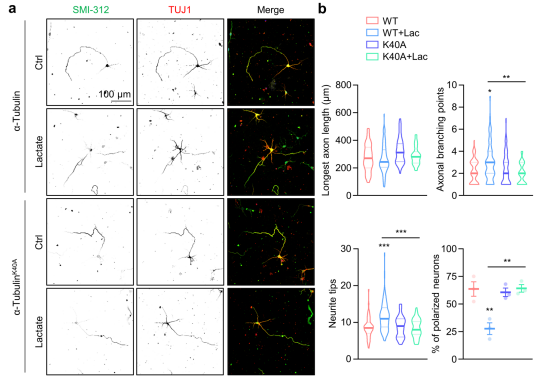
总结:本研究在可溶性微管蛋白二聚体中鉴定到α-微管蛋白K40赖氨酸的乳酸化修饰,并发现组蛋白去乙酰化酶(HDAC6)可利用乳酸催化α-微管蛋白的乳酸化修饰,从而增强神经元中微管的动态性。HDAC6 催化的乳酸化修饰具有可逆性,且依赖于乳酸浓度:细胞内乳酸浓度可触发 HDAC6对α-微管蛋白的乳酸化修饰,该过程依赖其去乙酰化活性。研究揭示了 HDAC6 在调控α-微管蛋白乳酸化修饰中的核心作用,建立了细胞代谢与细胞骨架功能之间的关联。
乳酸化和乙酰化的相互作用与代谢调控机制密切相关。吉凯可开展乳酸化+乙酰化修饰蛋白质组联合分析服务,且开学季现有买一赠二的活动(买乳酸化蛋白组学,送乙酰化蛋白组学,再送联合分析),欢迎感兴趣的小伙伴们扫码咨询哦!