上海吉凯基因医学科技股份有限公司品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
公司新闻/正文
生命起源密码被破译!多层蛋白质组学首次全景揭示哺乳动物胚胎发育黑箱~
61 人阅读发布时间:2025-12-05 14:21
在生命起点,受精卵如何一步步分化出构成生物体的万千细胞,最终形成复杂组织与器官?早期胚胎发育,特别是原肠胚形成阶段,一直是生物学研究的核心难题。这一时期,胚胎确立内、中、外三个胚层,为所有组织器官发育奠定基础。
尽管研究人员已通过成像、转录组测序等技术对类原肠胚细胞特化进行表征,但基因转录与蛋白质表达之间存在显著不一致,翻译后修饰对蛋白质功能的影响更是难以通过核酸研究完全揭示。这使得我们对胚胎发育的理解始终存在关键的"知识盲区"。
突破性研究
多层蛋白质组学系统描绘发育动态
2024年7月,国际顶刊《Cell Stem Cell》发表荷兰拉德堡德大学团队的突破性研究。该研究利用小鼠原肠胚样体模型,通过多层蛋白质组学技术(蛋白质组、磷酸化蛋白质组、单细胞蛋白质组等)首次系统描绘了早期胚胎发育过程中的蛋白质表达动态,实现了对发育分子机制的全方位捕捉。

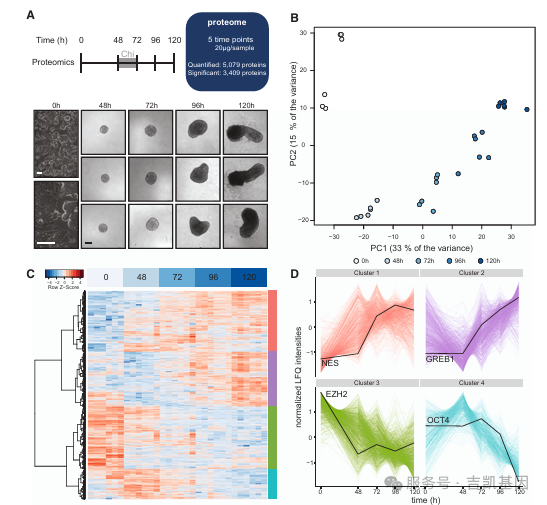
01 小鼠 mESC - 原肠胚样体分化:时间分辨蛋白质组
为解析原肠胚样体形成过程中蛋白质表达的动态变化,研究团队对未分化 mESCs(0h)至 120h 原肠胚样体的 5 个时间点进行了两次生物学重复实验,采用无标记定量(LFQ)质谱技术开展分析,共鉴定到 5079 种蛋白质,其中 87%-95% 的蛋白质在重复间重叠。
PCA分析显示,样本按发育时间点清晰分离,反映出分化过程中蛋白质组的显著动态变化,层次聚类将差异表达蛋白质分为 4 个簇,分别对应胚层形成与细胞谱系特化、胚层分化启动、多能性维持、晚期组织分化等过程。
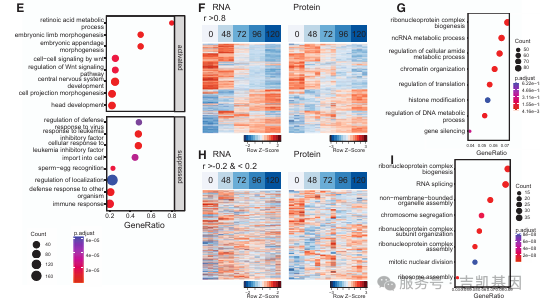
GO富集分析显示,120h 原肠胚样体中 “白血病抑制因子(LIF)响应” 通路受抑制(与多能性退出一致),而 “动物器官形态发生”“Wnt 信号通路”“神经发育” 等与胚胎分化相关的通路显著富集。通过同步生成各时间点 RNA-seq 数据,发现部分差异表达蛋白质与 mRNA 动态一致。
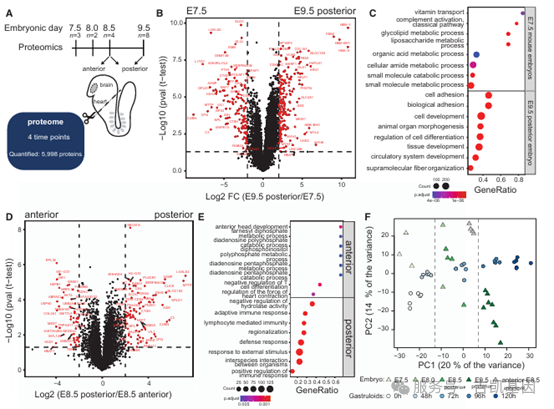
02 小鼠原肠胚样体与天然胚胎的蛋白质组比较
鉴于原肠胚样体可模拟胚胎着床后发育特征,而此前蛋白质组研究仅覆盖着床前胚胎,研究团队对胚胎日E7.5 至 E9.5 的小鼠胚胎进行了蛋白质组分析,并与原肠胚样体对比,天然胚胎共鉴定到 5998 种蛋白质,E9.5 胚胎中胚胎珠蛋白和肌球蛋白重链蛋白高表达,分别对应红细胞生成和心肌发育过程;E8.5 和 E9.5 胚胎被分为前体(头部区域)和后体(躯干区域),后体高表达 CDX4、HOXB9 等躯干发育相关蛋白,前体高表达 DDX10 及 RPL38(通过调控 Hox mRNA 翻译参与轴骨骼模式形成)。
肠胚样体与胚胎的蛋白质组共检测到 4736 种重叠蛋白质,胚胎特有的蛋白质富集于 “模式形成”“免疫反应”“心脏发育” 等通路(原肠胚样体缺乏这些复杂结构)。E9.5 胚胎与 96-120h 原肠胚样体高度匹配;且多能性(如 POU5F1)、神经发育(如 NES)、体节分化(如 MEST)相关蛋白的表达趋势在两者中一致,证实原肠胚样体可模拟天然胚胎的蛋白质组特征。
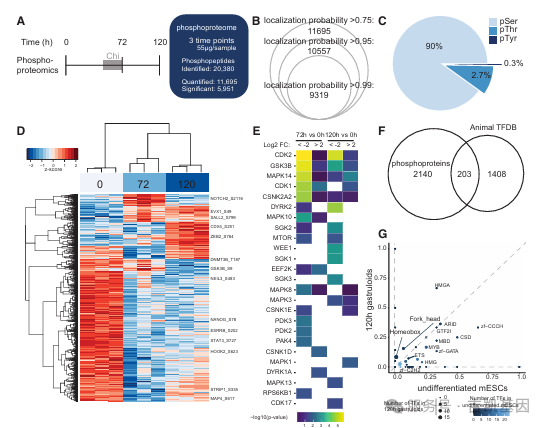
03 mESC向原肠胚样体分化的时间分辨磷酸蛋白质组
为解析信号通路在原肠胚样体形成中的动态调控,研究团队对 0h、72h、120h 样本进行磷酸蛋白质组分析,聚焦磷酸化修饰(翻译后修饰的关键形式)的变化,共鉴定到 20380 个磷酸化位点。在重叠蛋白质中,1151 种蛋白质同时存在表达量和磷酸化水平变化,412 种蛋白质仅磷酸化水平变化(与蛋白质表达无关),提示磷酸化修饰的独立调控作用。
信号通路与激酶活性动态:通路富集分析显示,120h 原肠胚样体中 “剪切应力信号” 受抑制,“RNA 剪接”“胚胎发育” 相关信号通路激活(与分化需求一致);激酶富集分析(KEA2)发现,未分化 mESCs 中 CDK2、CDK1、GSK3B、P38-MAPK14、DYRK2 等激酶活性更高,而 GSK3B 活性降低与原肠胚样体培养中使用 CHIR99021(GSK3B 抑制剂)处理一致。
转录因子的磷酸化特征:120h 原肠胚样体中磷酸化转录因子占比(9.2%)显著高于 72h(4.1%)和 0h(3.0%),且以 C2H2 型锌指家族为主(小鼠基因组中最大的转录因子家族),未分化 mESCs 中检测到多能性调控因子 KLF 家族的磷酸化;120h 原肠胚样体中鉴定到 SALL1 的多个磷酸化位点(抑制其与 NuRD 复合物结合并影响转录功能)、CTCF(S402 磷酸化降低 DNA 结合亲和力);同源域转录因子(如 HOXC9、IRX3)在 120h 原肠胚样体中特异性磷酸化,与早期胚胎细胞命运决定的已知功能一致。
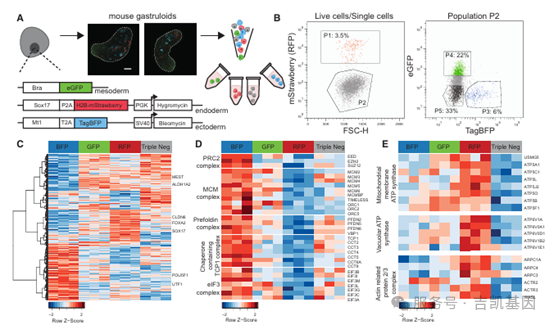
04 三个胚层的特异性蛋白质组与单细胞蛋白质组异质性
为解析内、中、外三个胚层的蛋白质表达特征及细胞异质性,研究团队构建了三重荧光报告基因 mESC 系(外胚层 MT1-BFP、中胚层 BRA-GFP、内胚层 SOX17-RFP),结合流式分选(FACS)、蛋白质组和单细胞蛋白质组(SCP)技术开展分析。
1、胚层特异性蛋白质组:
胚层细胞分选与验证:120h 原肠胚样体中,RFP+(内胚层)、BFP+(外胚层)、GFP+(中胚层)细胞占比分别约为 4%、6%、>20%,FACS 分选后 RNA 检测证实各群体高表达对应胚层标志物(如内胚层 FOXA2、外胚层 POU5F1、中胚层 MEST)。
胚层差异蛋白质表达:共鉴定到 4795 种蛋白质,其中 2708 种在 4 个细胞群体(3 个胚层 + 三阴性细胞)中差异表达,各胚层有不同特异性标志物。外胚层细胞中 PRC2 复合物、微小染色体维持复合物(MCM)、前折叠素复合物等表达上调,内胚层细胞中线粒体膜 ATP 合酶复合物、液泡 ATP 酶复合物、肌动蛋白相关蛋白 2/3 复合物富集;中胚层细胞中视黄酸信号通路相关蛋白高表达,三阴性细胞(以神经外胚层为主)富集神经发育相关通路。
2、单细胞蛋白质组(SCP)解析细胞异质性
SCP 检测深度与群体分离:对分选的 3 个胚层细胞和未分化 mESCs 进行 SCP 分析,560 个单细胞通过质控,共鉴定 2259 种蛋白质(单细均 1541 种);PCA 显示 675 个差异蛋白质(ANOVA q<0.01)可清晰区分不同细胞群体,且分离不受 TMT 标记影响;ANXA5(内胚层)、ESRRB(mESCs)、TGM1(中胚层)等蛋白质的表达与细胞类型高度匹配。
未分选原肠胚样体的细胞聚类:对未分选原肠胚样体单细胞分析(2088 种蛋白质 / 单细均 1424 种),UMAP 投影显示 mESCs 与胚层细胞形成独立簇,且多数原肠胚样体细胞与 BRA-GFP + 细胞(中胚层)聚类,符合原肠胚样体中胚层占比高的特征;随机打乱数据后聚类消失,证实聚类的生物学意义。
中胚层细胞的亚型细分:对 BRA-GFP + 细胞单独开展 SCP 分析(363 个单细胞,1822 种蛋白质 / 单细均 1605 种),通过 K-means 聚类识别出 3 个亚群,结合 scRNA-seq 标志物验证,分别对应体节前中胚层(PAFAH1B3、ALDH1A2)、神经中胚层祖细胞(NMP,TRHAP3、SUMO1)和体节(YBX3、RFC5),并发现角蛋白在特定中胚层亚群中富集(排除污染后提示其可能参与形态发生适应)。

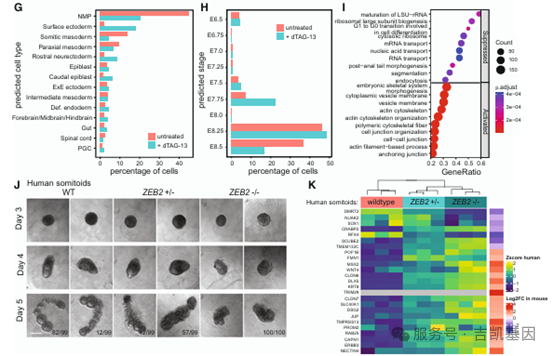
05 增强子相关蛋白质鉴定与ZEB2在体节发生中的关键作用
为解析胚胎分化中的转录调控机制,研究团队通过 P300 邻近标记鉴定增强子结合蛋白,并对关键转录因子进行功能验证。
1、 P300 邻近标记解析增强子蛋白质组
利用 CRISPR-Cas9 技术构建 P300-V5-miniTurboID 敲入细胞系,ChIP-seq 显示 mESCs 和 120h 原肠胚样体中分别检测到 31100 和 53474 个 P300 结合位点,且主要位于内含子和远端基因间区(增强子典型区域);P300 结合位点分为 mESC 富集(17437 个)、共享(13663 个)、原肠胚样体富集(39811 个)三类,共享位点的 ChIP-seq 信号最强。
motif 分析显示,mESC 富集的 P300 位点含 NANOG、SOX2、POU5F1 等多能性转录因子 motif,原肠胚样体富集位点含同源域 motif(如 HOX 家族)及 ZIC1/3/4、TCF7L2 等胚胎分化相关 motif;ANANSE 算法预测 HOX 转录因子、心房标志物(HEY1、NR2F2)及 RFX4 等为原肠胚样体分化关键调控因子。
对P300 邻近蛋白质鉴定,mESCs 中鉴定 250 种 P300 邻近蛋白,包括 Mediator 复合物、SWI/SNF 复合物及 SALL4、NANOG 等转录因子;原肠胚样体中鉴定 161 种 P300 邻近蛋白,含 64 种原肠胚样体特异性蛋白(39 种仅在原肠胚样体中检测),包括 SWI/SNF 复合物亚基 SMARCD3(神经祖细胞特异性)、GLTSCR1(GBAF 复合物成员,推测从启动子向增强子重定位),以及 PRTH/PHF14 复合物(与神经发育疾病相关);原肠胚样体中 ZEB2、NANOG 等转录因子的 P300 邻近富集显著(log2 FC>2,p<0.05),HOXB9、CDX2 等 log2 FC>1,且 DNA 亲和纯化与免疫荧光证实 HOX 蛋白在原肠胚样体中实际表达(解释 ANANSE 预测与邻近标记的差异)。
2、ZEB2 在小鼠和人类体节发生中的功能
ZEB2 在未分化 mESCs 中不表达,96h 后原肠胚样体中上调;免疫荧光显示 120h 原肠胚样体中 ZEB2 与 SOX17-RFP+(内胚层)细胞无重叠,且 scRNA-seq 证实其在 Sox17 + 细胞中不表达。scRNA-seq 显示 ZEB2 缺失后,神经中胚层祖细胞(NMP)和体节中胚层比例减少,表面外胚层和喙侧神经外胚层比例增加;ZEB2 缺失细胞更多被归为 E7.75(22.48% vs 野生型 7.6%),E8.5 比例降低(16.78% vs 野生型 36.87%),提示发育阻滞。
构建 ZEB2 敲除(-/-)和杂合(+/-)人类 iPSC 系,诱导形成体节样结构(somitoids):野生型 iPSC 形成多个体节样结构,ZEB2-/- iPSC 无法伸长,ZEB2+/- 呈中间表型(可伸长但无分节);RT-qPCR 和 RNA-seq 证实,小鼠中 ZEB2 缺失上调的基因(CLDN7、KRT8 等)在人类中同样上调,下调基因(DMRT2)一致;人类 ZEB2-/- somitoids 中表面外胚层标志物富集,轴旁中胚层标志物下调,与小鼠结果一致,证实 ZEB2 在哺乳动物体节发生中的保守功能。

研究意义与技术服务
本研究通过多层蛋白质组学技术,特别是结合单细胞蛋白组,首次系统描绘了早期胚胎发育过程中的蛋白质表达动态和调控网络,揭示了 mRNA 与蛋白质表达的不一致性,强调了翻译水平和翻译后修饰调控在胚胎发育中的重要作用。