上海吉凯基因医学科技股份有限公司品牌商
15 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
公司新闻/正文
IF12.5 | 肿瘤的“金钟罩”:肺癌通过乳酸化修饰抵抗铁死亡的全新机制!
109 人阅读发布时间:2025-12-05 14:22
铁死亡,作为一种铁依赖性的程序性细胞死亡方式,在肿瘤治疗领域展现出广阔前景。然而,肿瘤细胞如何逃避铁死亡的“追杀”,仍是亟待破解的难题。近日,复旦大学附属中山医院团队在《Cell Discovery》上发表重磅研究,首次揭示了肺腺癌中一种由SUMO2蛋白乳酸化修饰介导的新型铁死亡抵抗机制,并成功开发出一种能有效破解此机制、增强治疗效果的靶向穿膜肽。

本研究所使用慢病毒由吉凯基因提供。
研究背景
肿瘤的“代谢盾牌”
众所周知,肿瘤细胞即使在有氧条件下也倾向于进行糖酵解,产生大量乳酸。乳酸不仅是代谢废物,更能通过一种名为“乳酸化修饰”的蛋白质翻译后修饰,广泛影响基因表达和细胞功能。
与此同时,以脂质过氧化为特征的电死亡,是攻克化疗耐药的有效策略。研究人员发现,当诱导铁死亡时,肿瘤细胞内的乳酸水平和整体蛋白质乳酸化修饰水平会显著升高。这提示,铁死亡压力可能触发了肿瘤细胞的代谢重编程,而由此产生的乳酸化修饰,或许构成了肿瘤抵抗铁死亡的一层“代谢盾牌”。
核心发现
SUMO2-K11乳酸化是抵抗铁死亡的关键
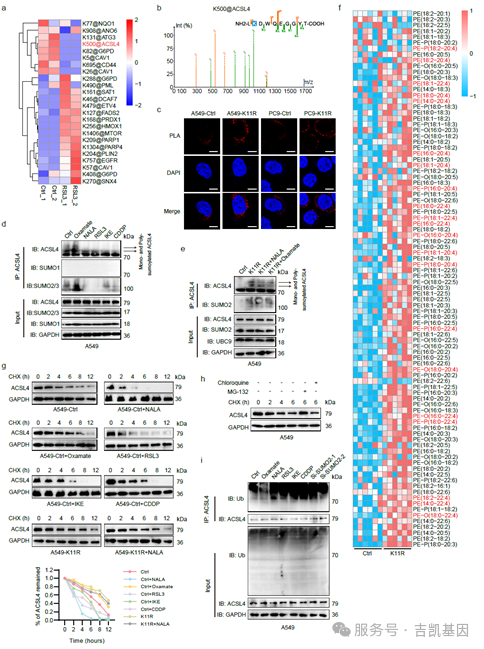
为了找到这面“盾牌”的核心,研究团队进行了乳酸化修饰组学分析。结果发现,在众多发生乳酸化修饰的蛋白中,SUMO2蛋白的第11位赖氨酸乳酸化修饰(SUMO2-K11la) 在铁死亡诱导后升高最为显著。
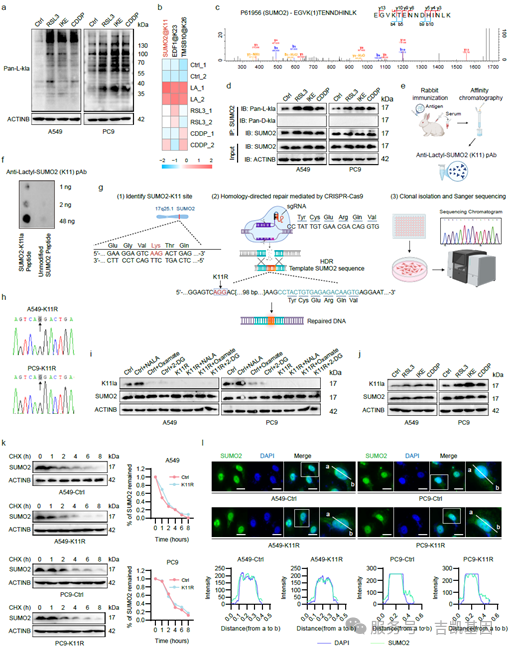
SUMO2本身是调控蛋白质“SUMO化修饰”的关键分子。研究人员通过基因编辑技术构建了无法发生K11乳酸化修饰的突变细胞株(SUMO2-K11R)。一系列实验证实:
○失去K11乳酸化后,肿瘤细胞对铁死亡的敏感性显著增强。
○这种效应可被铁死亡抑制剂逆转,而非凋亡或坏死性凋亡抑制剂。
○临床数据分析显示,LUAD患者肿瘤组织中SUMO2-K11la水平越高,预后越差。
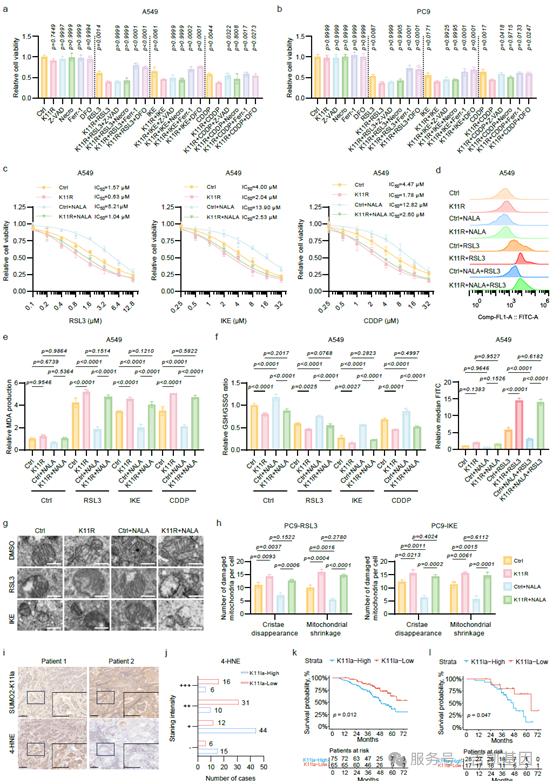
机制阐明
研究团队通过苏木化蛋白组学瞪眼技术揭示SUMO2-K11la发挥作用的机制。
1. 削弱ACSL4蛋白的SUMO化:ACSL4是推动铁死亡发生的核心酶。研究发现,SUMO2-K11la会阻碍SUMO2与ACSL4的结合,从而抑制ACSL4的SUMO化修饰。
2.促进ACSL4蛋白降解:失去SUMO化修饰的ACSL4,更容易被泛素化标记,并通过蛋白酶体途径被降解。
3.此外,研究还锁定了负责催化SUMO2-K11la的“书写器”AARS1和负责移除该修饰的“擦除器”HDAC1,完善了这一调控环节。
转化应用
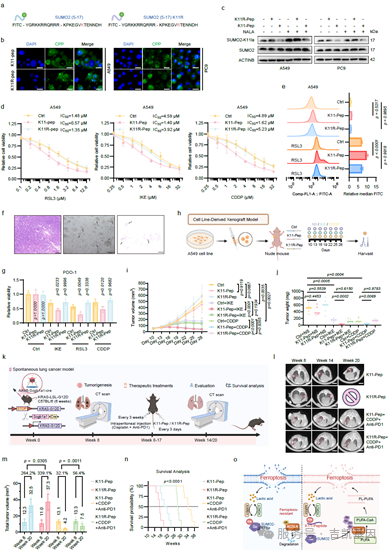
✦ 靶向穿膜肽显疗效
基于上述机制,研究团队设计了一种能够穿透细胞膜的靶向肽——K11-Pep。该肽段能竞争性地抑制SUMO2的K11乳酸化修饰。
在多种临床前模型中,K11-Pep均显示出卓越的治疗潜力:
○在患者来源类器官中,K11-Pep显著增强了类器官对铁死亡诱导剂和化疗药顺铂的敏感性。
○在移植瘤模型中,K11-Pep有效抑制了肿瘤生长。
○在自发性肺癌模型中,K11-Pep与“顺铂+抗PD-1”的 化免方案联用,能显著降低肿瘤负荷、延长小鼠生存期,并增加肿瘤内杀伤性T细胞的浸润。
总结与展望
本研究首次揭示了SUMO2-K11乳酸化修饰是肺腺癌抵抗铁死亡的一种新型机制。该工作不仅深化了对肿瘤代谢与细胞死亡交叉调控的理解,更重要的是,其所开发的细胞穿膜肽,为实现靶向铁死亡的联合治疗提供了有前景的新策略,为克服肺腺癌的治疗耐药带来了新的希望。
吉凯助力
本研究所使用慢病毒由吉凯基因提供
文献来源:
Shan et al. Ferroptosis-induced SUMO2 lactylation counteracts ferroptosis by enhancing ACSL4 degradation in lung adenocarcinoma. Cell Discovery (2025).